细胞治疗产品研发如火如荼,新兴技术悄然兴起
- 2021-01-28 10:54
- 作者:宗毛毛
- 来源:火石创造
目前各个国家和地区对细胞治疗产品(Cellular Therapy Products)的定义都不尽相同,国内对细胞治疗产品暂无统一界定。原国家食品药品监督管理总局发布《细胞治疗产品研究与评价技术指导原则(试行)(2017年第216号)》中提出,细胞治疗产品是指用于治疗人的疾病,来源、操作和临床试验过程符合伦理要求,按照药品管理相关法规进行研发和注册申报的人体来源的活细胞产品。
一般而言,细胞治疗产品是指将人自体或异体细胞经过体外处理,回输人体后治疗或预防疾病的产品,其中体外操作包括细胞在体外的传代、扩增、筛选以及给予药物或其他能改变细胞生物学行为的处理,细胞治疗产品中经过处理的细胞发挥了主要治疗或预防疾病作用。
目前,学界对细胞治疗范围尚无明确统一界定,一般认为,细胞治疗包括免疫细胞治疗、干细胞治疗和其他细胞治疗(例如软骨细胞,既不属于干细胞也不属于免疫细胞)。
免疫细胞治疗(cell-mediated immunotherapy)是通过采集人体自身免疫细胞,经过体外修饰和培养,大量扩增出靶向性杀伤功能增强的免疫效应细胞,然后再回输到患者体内,从而杀灭血液及组织中肿瘤细胞的疗法。干细胞(stem cells)是一类具有自我复制的多潜能细胞,在一定条件下可以分化成多种功能细胞。
图1 细胞治疗产业细分领域情况
资料来源:《深圳市细胞治疗研究报告(2016)》
市场表现
(一)产品概览
目前全球已上市40余款细胞治疗产品(含已撤市产品),其中免疫细胞治疗产品仅有5款获批上市(其中3款为CAR-T细胞,1款为DC细胞,1款为T细胞),其余均为干细胞治疗产品和其他细胞治疗产品。从首次上市国家和地区来看,主要在美国、韩国、日本和欧盟等,我国暂无细胞治疗产品获批上市。从上市时间看,细胞治疗产品都集中在2000年以后。从适应症看,干细胞产品的适应症更广,如癌症、神经系统疾病、心血管疾病、代谢系统疾病、消化系统疾病等;免疫细胞产品主要用于治疗血液肿瘤;其他细胞治疗产品多用于组织损伤修复。
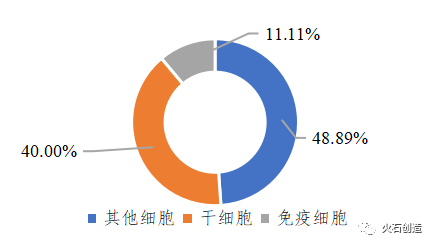
图2 已上市细胞治疗产品分类
数据来源:火石创造公开资料整理
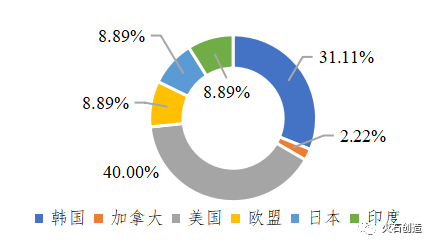
图3 已上市细胞治疗产品首次上市国家/地区
数据来源:火石创造公开资料整理
国内免疫细胞治疗领域,大多集中在CAR-T领域,超过80%的企业成立时间在2015年之后(已有CAR-T产品获批临床试验的企业)。2020年,国内有两款CAR-T细胞疗法产品提交上市申请,并被纳入优先审评,分别为复星凯特从Kite Pharma引进的抗人CD19 CAR-T细胞治疗产品益基利仑赛注射液(暂定)和药明巨诺在美国Juno公司JCAR017基础上自主开发的CD19 CAR-T疗法产品瑞基仑赛注射液(暂定)。目前国内已有多家企业的CAR-T研发项目推进至临床阶段,截至2020年第3季度,全国共有34个临床申报获得CDE受理,进度领先的有复星凯特、优卡迪、金斯瑞(南京传奇)、西比曼、科济生物、博生吉安科等。
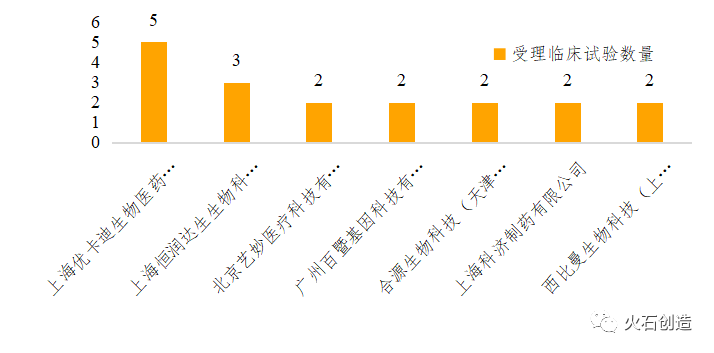
图4 国内CAR-T临床试验受理数量TOP5企业
数据来源:CDE,火石创造整理
我国干细胞上游较为成熟,下游应用有待开发。相比国外成熟的干细胞产业链,我国干细胞行业仍处于起步发展阶段,仅干细胞上游制备和存储产业较为成熟,现今大多数干细胞药物仍处在研发阶段,还未有干细胞治疗产品获批上市。截至2020年第3季度,按照我国《干细胞临床研究管理办法(试行)》,目前国家卫健委公布的干细胞临床研究备案机构共119家(含12家军队医院),我国医学研究登记备案信息系统和卫健委公布的干细胞临床研究备案项目共34个,CDE临床试验登记平台登记的国产干细胞药物临床试验共4个。
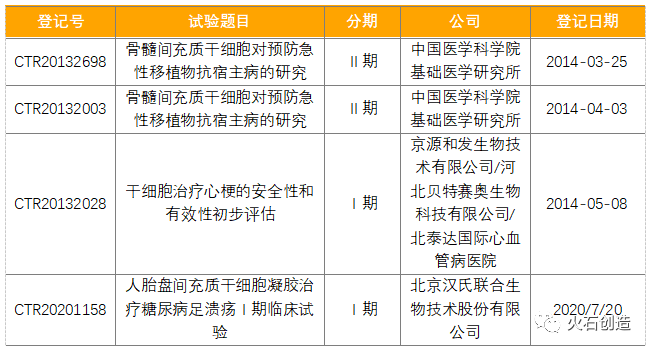
表1 我国已登记干细胞药物临床试验明细
数据来源:CDE,火石创造整理
(二)全球市场
细胞治疗产品是生物医药市场增长最快的子领域之一。在干细胞领域,2014年全球干细胞治疗市场规模约为507亿美元,2018年全球干细胞治疗市场规模达1370亿美元,年复合增长率高达22%。预计未来干细胞治疗市场增速将持续维持在20%以上。
免疫细胞领域,据Coherent Market Insights预测,在2018-2028年期间,全球CAR-T细胞治疗市场价值将以高达46.1%的平均年复合增长率增长。在未来一段时间内,北美仍将占据全球CAR-T细胞治疗50%以上的市场份额,欧洲市场居于次席。但随着我国CAR-T相关政策的推进以及研发力度的增强,越来越多的企业涌入CAR-T行业市场,我国有望在未来短时间内弯道超车,占据很大一部分全球市场份额。
截至2020年第3季度,全球共有3款CAR-T产品获批上市。2017年是细胞治疗领域的关键一年,Kymriah和Yescarta相继获得美国FDA批准,标志着CAR-T疗法获得市场批准。截至2019年,Kymriah与Yescarta的销售额分别为2.7亿美元和4.5亿美元,年增速分别高达260%和70%。2020年7月24日,美国FDA加速批准吉利德子公司Kite另一款CAR-T细胞治疗产品Tecartus上市,用于治疗成人复发或难治性套细胞淋巴瘤(MCL),至此全球已有3款CAR-T细胞治疗产品获批上市。
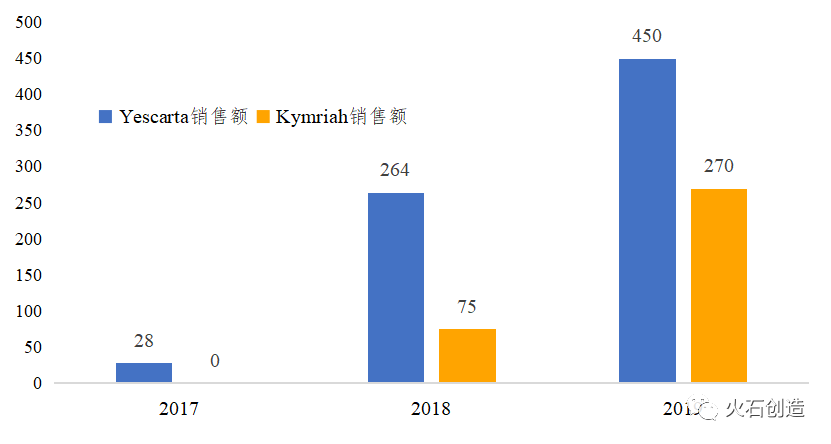
图6 全球已上市CAR-T细胞治疗产品年度销售额(百万美元)
数据来源:公司年报(Tecartus暂无销售数据)
(三)国内市场
我国虽然暂未有细胞治疗产品获批上市,但发展劲头十足。在全球范围内,中美两国细胞免疫疗法领跑全球。根据Clinical Trials数据,截至2020年3季度,全球CAR-T临床试验共计1103项,其中中美两国CAR-T临床试验数量超过全球总数的70%,位处第一梯队,远远高于其他国家,第二梯队国家有加拿大、法国、英国、意大利等。
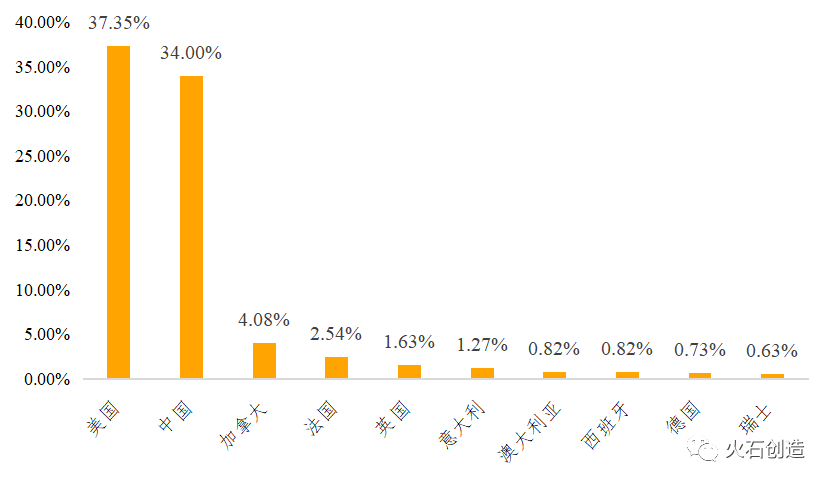
图7 全球CAR-T临床试验数量TOP10国家占比(截至2020 Q3)
数据来源:Clinical Trials
政策导向
我国细胞治疗产品领域呈现“鼓励+规范”双向促进的政策导向。在过去十年中,我国在细胞治疗领域出台了一系列重要的政策和法规,尤其是2015年以来,特别是2020年,政策的支持使得包括干细胞和免疫细胞治疗在内的细胞治疗领域的发展增速。目前深圳市在国家综合改革试点等系列政策支持下,正在积极探索细胞立法,以规范和促进深圳市细胞治疗产业的良性和稳步发展。
目前我国细胞治疗产品按药品、医疗技术管理的“双轨制”监管。企业的细胞制剂鼓励按药品申报,由国家药监局按照药品进行监管,临床试验需要进行申报和备案;医疗机构主导的生物医学新技术,即医院制剂可按医疗技术进行管理,由卫健委进行备案监管。细胞产品的监管也称为“双备案”制度,例如拟开展干细胞临床研究的机构,应当将完整的机构备案材料和拟研究项目备案材料一并经省级卫生健康行政部门和药品监管部门审核后,报国家卫生健康委、国家药监局备案。
在国家政策支持下,国内细胞治疗产品迎来临床试验与上市申请“快车道”。截至2020年3季度,国内已有2款细胞治疗产品被纳入突破性治疗品种目录,分别是传奇生物的LCAR-B38M CAR-T细胞自体回输制剂与上海明聚生物的CAR-T细胞疗法JWCAR029(暂定名:瑞基仑赛注射液);截至2020年3季度,国内共有4款CAR-T产品被纳入优先审评程序,4款产品所属企业分别为南京传奇生物科技有限公司(LCAR-B38M CAR-T细胞自体回输制剂)、北京马力喏生物科技有限公司、上海恒润达生生物科技有限公司、科济生物医药(上海)有限公司。
发展趋势
目前,肿瘤细胞免疫治疗已经从第一代的LAK细胞发展到第六代的CAR-T细胞(如下表),伴随抗肿瘤的特异性和靶向性增强,同时杀伤活性和持久性也增强。
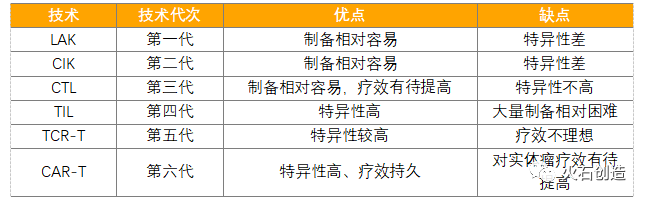
表2 免疫细胞治疗技术代次优缺点
资料来源:《深圳市细胞治疗研究报告(2016)》
以CAR-T为代表的免疫细胞疗法,在现有技术的升级迭代基础上,也逐渐衍生出许多新的技术。
● 自体型CAR-T应用受限,通用型正在路上
由于目前大部分的CAR-T细胞都是利用患者自身的T细胞来产生的,属于个体化产物,而患者与患者之间存在个体差异,产生定制T细胞是一个昂贵且耗时的过程。除此之外,每种CAR具有固定的抗原特异性,每种CAR-T制剂仅能靶向特定的表位,因此为了提高CAR的灵活性,科学家们致力于开发一种通用型CAR-T(UCAR-T)。
● CAR-T技术持续改进,新兴技术悄然兴起
CAR-T疗法的应用依然面临包括缺乏足够的持久性、抗原逃逸会导致复发、安全性低以及生产制备等方面的问题,因此CAR-T技术的改进是其发展的重要方向,包括:借助基因编辑工具设计通用型CAR-T、减轻CAR-T免疫疗法毒性、将CAR-T作为药物递送工具等。同时,一些新的细胞治疗技术也正在悄悄兴起,如CAR-NK技术等。
● CAR-T在实体瘤的突破为下一个科技攻关难点
由于应用CAR-T治愈白血病和淋巴瘤已经没有悬念,目前众多企业正在瞄准癌症治疗中最后的难点——实体瘤,进行下一阶段的科技攻关。
干细胞疗法方面,近年来,基于慢病毒载体和基因编辑结合自体造血干细胞移植的基因编辑干细胞技术得到了长足发展,同时在临床应用方面也展现出了极大的潜力。除此之外,干细胞治疗技术研究热点主要集中于干细胞分化与再生医学、干细胞的免疫调节和疾病干预、干细胞外泌体技术、干细胞药物筛选模型等领域。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐












