曝光台|国家药监局公布医疗器械企业飞行检查通报 维视达康被责令停产整改
- 2021-05-14 20:28
- 作者:陆悦 宋佳薇
- 来源:中国食品药品网
中国食品药品网讯(记者陆悦 实习记者宋佳薇) 5月8日,国家药品监督管理局网站发布《国家药监局关于北京维视达康科技有限公司停产整改的通告(2021年第31号)》(以下简称《通告》)。《通告》显示,国家药监局组织对北京维视达康科技有限公司(以下简称维视达康)进行了飞行检查。经检查,发现该企业质量管理体系在3个方面存在严重缺陷,不符合医疗器械生产质量管理规范相关规定。
《通告》显示,在机构与人员方面,维视达康生产车间二楼房间存放大量隐形眼镜半成品,企业员工称其中部分为帮助外部企业进行切削加工和培训检验用,同时在成品库房发现带料模具接收和领料切削加工表单。企业管理者代表称不知悉上述情况,也未能对相关员工的上述行为进行管理。
在生产管理方面,现场检查发现企业生产车间二楼房间存放大量隐形眼镜半成品,仅简单标识规格、数量,未标识相应批号,无法提供相应记录或台账,无法追溯。
在质量控制方面,企业《出厂检验规程》规定出厂检验包括后顶焦度、基弧半径等项目,备注中注明“出厂检验项目中未包含折射率、含水量、光透过率、透氧系数等,当原材料、配方不发生变化时,这些项目不发生变化,所以出厂检验项目不设置这些项目”,但企业未能提供出厂检验不设置相关项目的验证材料或数据。
公开资料显示,维视达康成立于2007年6月,注册资本50万元,法定代表人为潘可华,经营范围包括生产III类III-6822-1植入体内或长期接触体内的眼科光学器具和技术开发,主要产品为软性亲水接触镜。
为了解企业整改情况,记者致电维视达康,电话接通记者表明来意,一位女性工作人员表示,监管部门已经和企业进行约谈,且企业目前正处于停产整改的状态,至于整改的具体事项,对方则表示:“我不清楚,我们有具体负责的人在跟进。”
一名医疗器械检查员告诉记者,飞行检查由于它的不提前告知性,不给企业准备时间,更能看到企业最真实的生产管理状况。一般情况下,质量管理“存在严重缺陷”并不能和“产品质量不合格”直接划等号,但这意味着其产品质量安全风险较之质量管理规范的企业更高。
记者在天猫和京东电商平台上搜索“维视达康”发现,该企业的“软性亲水接触镜”产品在售。
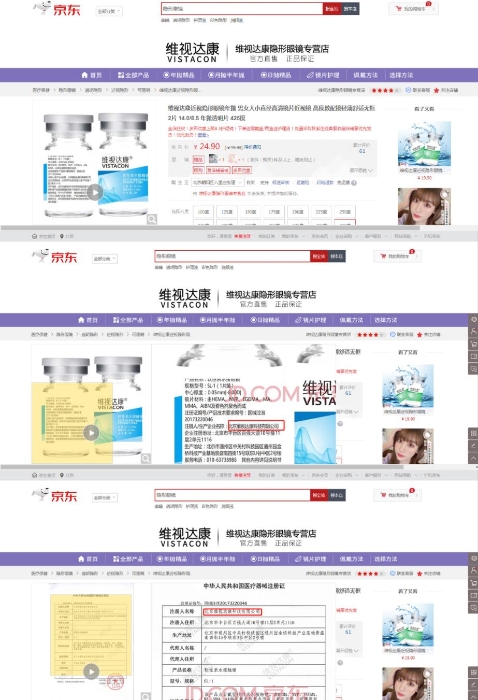
图为京东截图。
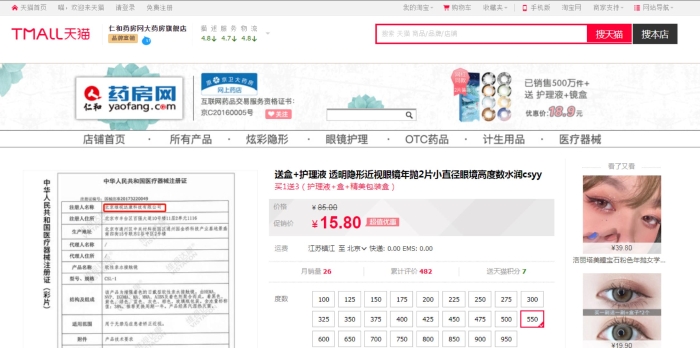
图为天猫截图。
另据《通告》,维视达康已对上述其质量管理体系存在缺陷予以确认。
国家药监局责成北京市药品监督管理局依法责令该企业立即停产整改,对涉及违反《医疗器械监督管理条例》及相关法律法规的,依法严肃处理;责成北京市药品监督管理局责令该企业评估产品安全风险,对有可能导致安全隐患的,按照《医疗器械召回管理办法》的规定召回相关产品;该企业完成全部项目整改并经北京市药品监督管理局复查合格后方可恢复生产。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:张可欣)
分享至
右键点击另存二维码!
-
为你推荐
-

国家药监局批准2款创新药上市
近日,国家药监局批准江苏晨泰医药科技有限公司申报的1类创新药盐酸佐利替尼片上市,通过优先审评审批程序附条件批准上海正大天晴医药科技开发有限公司申报的1类创新药格索雷塞片上市。 2024-11-22 10:23 -

互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有










