每周医药看点(8.3—8.9)
- 2022-08-11 09:58
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 国家医保局发布《医保定点医疗机构药学、技术人员统一编码规则和方法》;国家药典委公示6个国家药品标准草案……8月3日—8月9日,医药行业的这些动态值得关注。
行业政策动态
1.国家医保局发布《关于印发医保定点医疗机构药学、技术人员统一编码规则和方法的通知》,旨在加快推进统一的医保信息业务编码标准,形成全国“通用语言”。
2.国家药监局药品审评中心(CDE)就《以患者为中心的临床试验实施技术指导原则(征求意见稿)》《以患者为中心的临床试验设计技术指导原则(征求意见稿)》《以患者为中心的临床试验获益-风险评估技术指导原则(征求意见稿)》公开征求意见,以上征求意见截止日期均为2022年9月8日。
3.国家药典委公示6个国家药品标准草案,分别为吉他霉素、吉他霉素片、甲苯磺酸托氟沙星(曾用名:甲苯磺酸妥舒沙星)、甲苯磺酸托氟沙星片(曾用名:甲苯磺酸妥舒沙星片)、甲苯磺酸托氟沙星胶囊(曾用名:甲苯磺酸妥舒沙星胶囊)、甲苯磺酸托氟沙星分散片(曾用名:甲苯磺酸妥舒沙星分散片)标准草案,上述药品标准草案公示期均自发布之日起3个月。
产品研发/上市信息
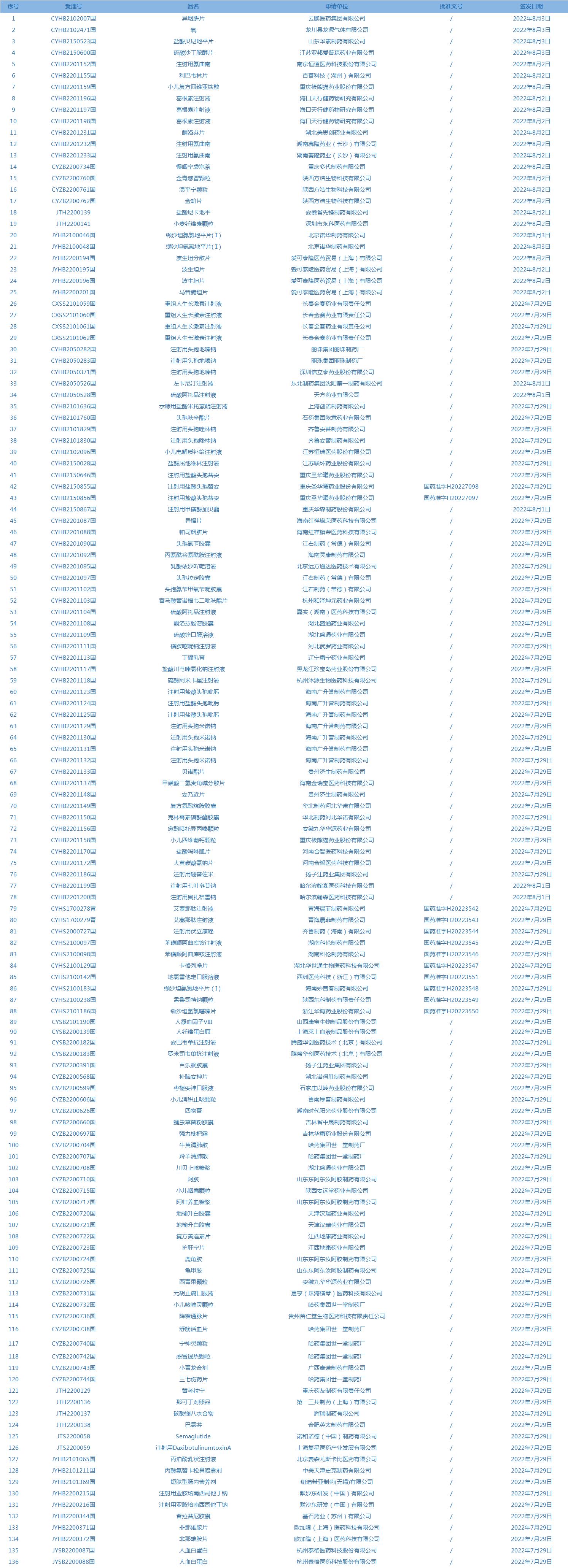
1.国家药监局发布2期药品批准证明文件待领信息,共包括136个受理号,涉及云鹏医药集团有限公司等企业。(截至8月9日)
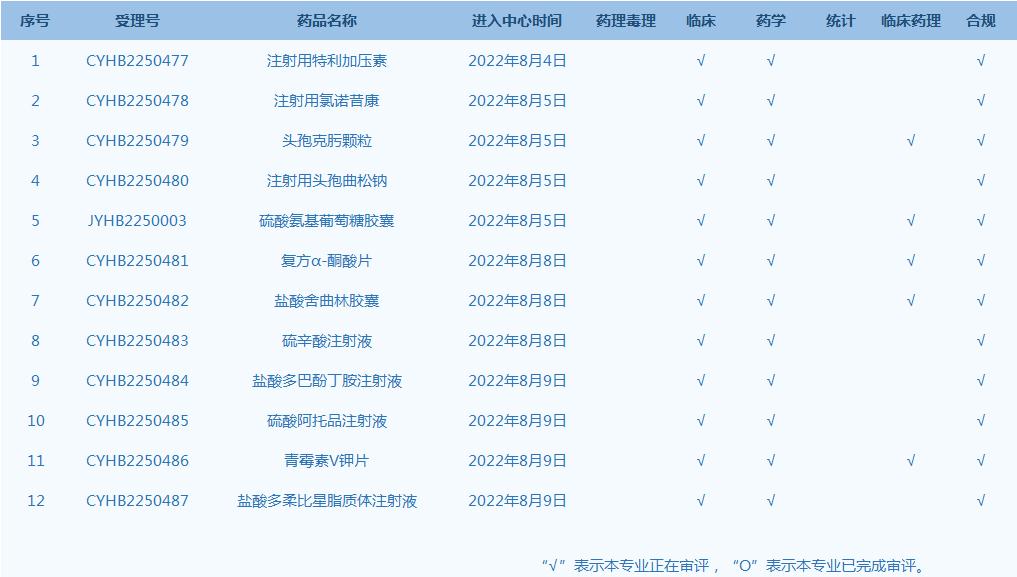
2.CDE网站公示12个仿制药一致性评价任务,涉及注射用特利加压素等药品。(截至8月9日)
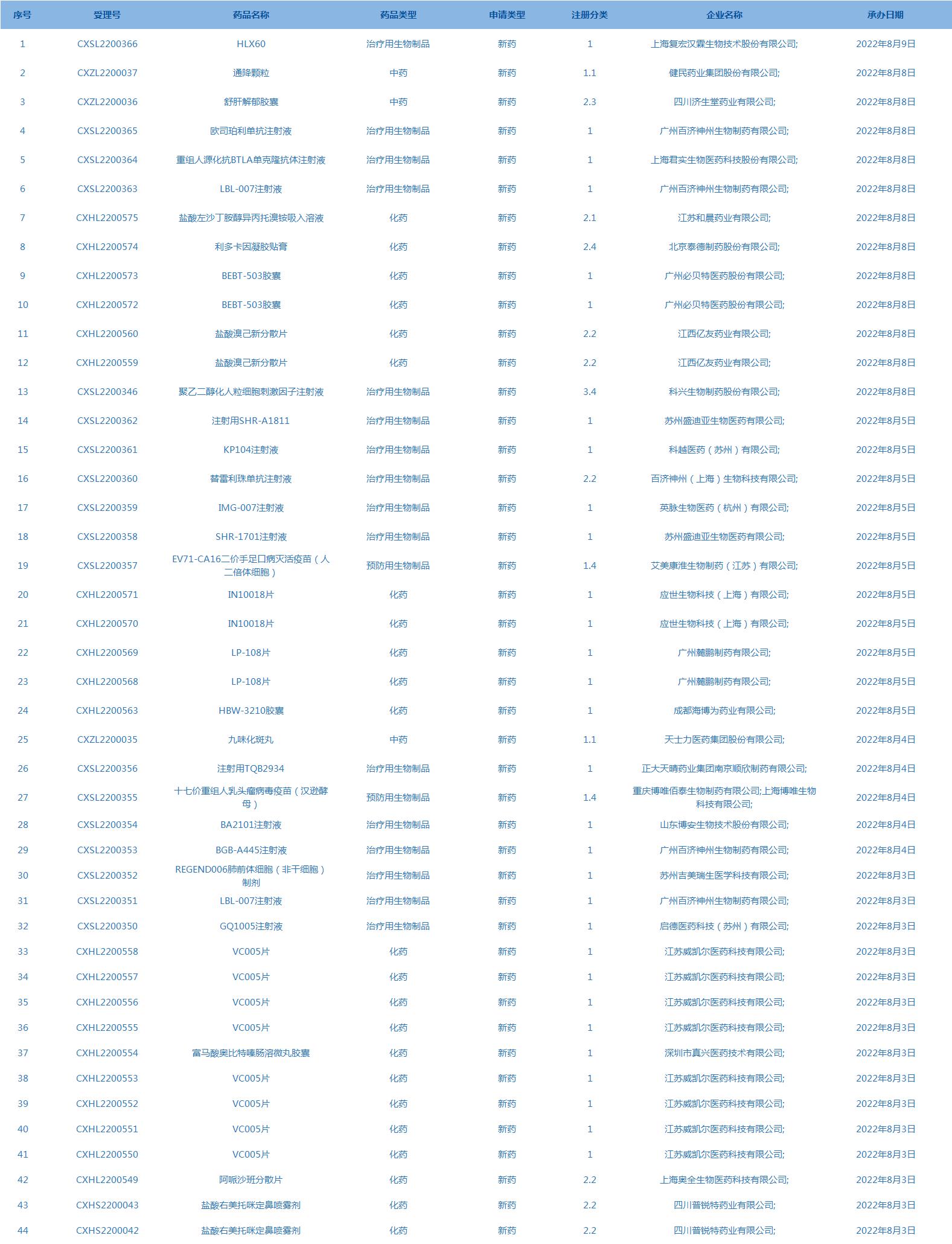
3.CDE承办受理44个新药上市申请,包括欧司珀利单抗注射液等药品。(截至8月9日)
医药企业观察
1.信达生物发布公告称,已与赛诺菲达成多项目战略合作及许可协议,以合作开展两款高潜力抗肿瘤药物SAR408701(Tusamitamab Ravtansine;抗CEACAM5抗体-药物偶联物)及SAR444245(非α偏向性IL-2)在中国的临床开发及商业化,包括探索联合PD-1抑制剂达伯舒®(信迪利单抗注射液)的一系列临床研究,旨在加速创新疗法的开发及市场准入。另外,双方还达成股份发行协议,赛诺菲将通过认购股份的方式投资信达生物。首次认购将以每股42.42港元的价格发行共56975670股股份,现金总额为3亿欧元。未来,双方若达成新的协议,赛诺菲还可再次认购价值总额为3亿欧元的信达生物股份。
2.普利制药发布公告称,收到新西兰药品管理局签发的注射用泮托拉唑钠的上市许可。
3.甘李药业宣布全资子公司甘李药业美国公司获得IND批文,美国食品药品管理局(FDA)正式批准GZR4在美国开展1期临床试验。GZR4为甘李药业在研的每周皮下注射给药一次的超长效胰岛素周制剂,适应症为糖尿病。
4.奥赛康药业发布公告称,其子公司奥赛康生物近日收到澳大利亚人类研究伦理委员会签发的批准ASKG315开展I期临床试验的临床试验伦理许可,并将向澳大利亚药品管理局进行临床试验备案。
5.葆元医药宣布,其在研ROS1抑制剂他雷替尼获得美国FDA颁发的突破性疗法认定,用于治疗既往未经ROS1酪氨酸激酶抑制剂(TKI)治疗或既往接受过克唑替尼治疗的晚期或转移性ROS1阳性非小细胞肺癌(NSCLC)成人患者。
6.翰森制药与韩国TiumBio公司共同宣布,双方就后者在研药物TU2670达成在中国的开发、注册审批及商业化独家许可协议。根据协议,翰森制药获得TiumBio公司在中国的独家许可,开发并商业化TU2670用于子宫内膜异位症和子宫肌瘤及其他潜在适应症的治疗。TiumBio公司将获得450万美元首付款,150万美元的技术转让费及最多1.64亿美元的开发、注册及基于销售的商业化里程碑潜在付款,以及基于产品净销售额的分级特许权使用费。
7.亦诺微医药与华润生物医药共同宣布签署合作协议,将于大中华区域排他性合作开发用于治疗以神经胶质瘤为主的中枢神经系统(CNS)肿瘤的溶瘤病毒产品MVR-C5252。
8.厌氧生物宣布完成亿元A轮融资,本轮融资由道彤投资和成都科创投共同领投,创东方投资、中喜基金跟投。本轮融资资金将主要用于人才团队建设、活菌药物2期临床试验、候选药物管线研发和菌药生产平台搭建。
9.盛睿泽华宣布完成数千万元天使轮融资,由凯泰资本独家投资。本次募集资金将主要用于支持公司现有产品管线研发、自有药物开发技术平台化及相应的知识产权保护设立工作,为公司未来的发展打下良好及坚实的基础。
10.硕迪生物宣布完成3300万美元的超额认购融资。此次融资包括的新投资者有Deep Track Capital和Piper Heartland Healthcare Capital。融资所得资金将用于推进硕迪生物临床研究中的领先项目,并扩大其下一代基于结构的药物发现平台的应用,以推动G蛋白偶联受体(GPCR)靶向疗法的创新。
药品集中采购
1.甘肃省公共资源交易中心发布《关于开展第二批和第四批国家集采协议期满药品接续采购未中选药品挂网申报工作的通知》,申报时间为2022年8月3日至2022年8月14日,未按要求进行申报或未申报的,做暂停或取消挂网处理。此次申报范围为第二批和第四批国家集采协议期满已接续采购的同通用名同大类剂型(如阿德福韦酯口服常释剂型)未中选药品,包含同通用名同剂型不同规格药品。结果经公示无异议后分批次进行挂网或暂停(取消)挂网。
2.江苏省医保局发布《关于开展医保定点零售药店参与带量采购和阳光采购工作的通知》,明确医保定点零售药店对带量采购中选药品实行“零差率”销售。对省平台带量采购中选药品、国家谈判药品、省级储备药品外的其他阳光挂网药品,定点药店在采购时应主动开展议价,按议价结果采购,并在不高于挂网价前提下合理确定销售价格。
3.上海阳光医药采购网发布《关于开展全国药品集中采购(GY-YD2022-1)上海地区中选供应药品及备选供应药品申报挂网工作的通知》。通知指出,自2022年8月5日起,企业可登录“上海市医药采购服务与监管信息系统”,进入“药品申报”子栏目,在挂网类型中选择“全国药品集采上海地区中选供应药品”通道申报药品相关信息。企业申报时须在“申报情况说明”中注明“主供”或者“备供”。申报挂网截止时间为2022年8月26日。【中国食品药品网综合整理/刘思慧】
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐