以信息化驱动现代化 广东纵深推进药品智慧监管成果丰硕
- 2024-06-05 09:41
- 作者:陈海荣
- 来源:中国医药报
今年3月,广东省药监局智慧监管平台与江西省药监局智慧监管平台实现对接,依托国家药品智慧监管平台,两个省级药监局的许可系统通过与各自局内一体化平台的接口对接,实现高效、畅通、透明的跨省药品委托生产业务对接。这意味着,由广东省药监局牵头的药品委托生产跨省协同监管试点成功启动。4月份,广东省药监局与海南省药监局也实现监管平台对接,药品委托生产跨省协同监管“高速公路”持续延伸。
广东地处改革开放前沿阵地,药品监管现代化的新任务、新使命尤为突出。近年来,广东省药监局充分利用云计算、大数据、人工智能、区块链等信息技术,整合药品、医疗器械和化妆品监管资源,汇聚研发、生产、经营、使用各环节数据,推动加强医疗、医药、医保部门协同,构建标准统一、数据共享、业务协同、运行高效的“智慧药监”信息化系统,实现省、市、县(区)、镇(街)一体化融合,推动药品监管从数字化向智能化、从智能化向智慧化发展,并在粤港澳大湾区融合监管、药械化高风险重点领域监管、药品委托生产跨省协同监管试点等工作中呈现诸多亮点,走在全国前列。
苦练智慧监管基本功
“打铁还需自身硬”,智慧监管需要扎实的基本功。近年来,广东省药监局通过推动制度优化、流程再造、系统重塑,加快实现药品监管现代化,结合新体制下全省“一网统管”整体思路,利用省政务云平台支撑能力,按照“一个平台、两个支撑、三大保障、四大服务、五大应用”的总体框架,建设覆盖药品、医疗器械、化妆品全品类、全业务、全流程的广东省智慧药监一体化平台。
广东省药监局充分应用“数字政府”强有力的公共资源整合能力,统一数据标准、门户及权限身份认证,规范数据出入口、业务处理及服务管理,形成统一支撑体系,为广东药品监管工作提供强有力的支撑。
此外,结合国家药监局品种档案、信用档案数据标准规范,广东省药监局从业务领域、数据分类及数据实体自上而下梳理药品监管企业库、人员库、产品库的数据实体及数据属性,形成三大库数据标准,并对全省的药品监管全品种、全过程、全业务数据进行专项数据治理,构建产品、人员、企业库,并实现跨地区、跨部门、跨层级的数据共享共用。
为打破各部门业务壁垒,广东省药监局以全局、整体的思路整合资源、优化流程,提高跨部门协同能力。全面整合行政许可、日常检查、抽样检验、风险监测等监管业务的应用系统,实现各业务系统一次登录、一网通办。通过各业务应用系统间的数据共享共用和业务协同联动,构建标准统一、整体联动、深度融合的业务应用体系,夯实智慧监管基础。
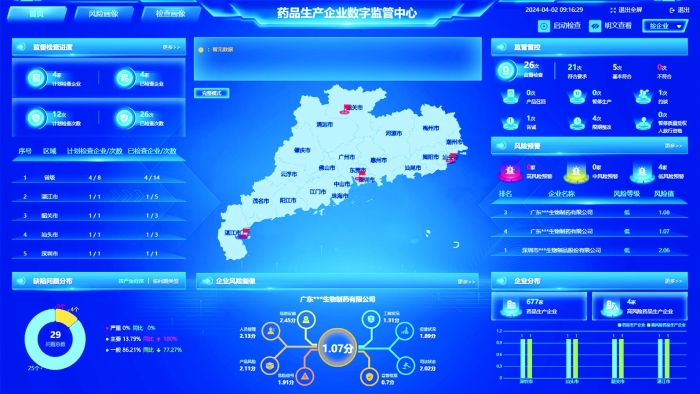
图为广东省高风险药品数字化监管系统监测大屏。 广东省药监局供图
确保监管跑在风险前面
对于血液制品、疫苗等高风险药品,广东省药监局根据生产监管的关键点、关键环节、风险关注点,梳理总结生产、原材料、检验、存储、出库、冷链运输等环节的共性要求,建设数字化监管系统。
通过应用5G、大数据、云计算、远程视频、智能分析等“互联网+”新技术,广东省药监局积极创新高风险药品生产企业数字化监管方式。通过对高风险药品生产企业实现数字化监管的先行试点,该局初步建立起广东省高风险药品数字化管理标准、业务数据标准、数据接口标准,实现六大监管亮点:一是通过数据要素采集到药品企业生产关键过程数据;二是利用AI视频智能监测企业生产行为,实现全过程自动化监管;三是连接企业视频监控实现远程监管,打破药品生产过程监管壁垒;四是以模型驱动实现风险主动发现,让监管跑在风险前面;五是通过多层次多领域关键指标数字中心,辅助科学管控;六是融合新技术建构服务企业新场景,通过新业态服务促进药品安全监管。
推动大湾区药械监管机制创新
为贯彻落实国家药监局等八部门联合发布的《粤港澳大湾区药品医疗器械监管创新发展工作方案》要求,推动粤港澳大湾区药品医疗器械监管创新发展,广东省药监局积极建设粤港澳大湾区药械创新监管应用项目“港澳药械通”,让大湾区居民治病更便利,受到行业及公众高度关注。
目前,“港澳药械通”改革项目正向智慧监管方向发力。
针对“港澳药械通”覆盖的粤港澳大湾区内地9市的进口、注册、生产、流通和使用各环节的监管需求,广东省药监局建立粤港澳大湾区药品医疗器械监管创新审批系统和粤港澳大湾区内地临床急需进口港澳药械流通管理系统,助力大湾区药械监管机制创新,中药产业有机融合。
上述审批系统和流通管理系统建设工作,既充分考虑国家药品医疗器械监管体制,又尊重港澳监管机制差异。广东省药监局主动推动粤港澳监管机制对接,实现技术与数字驱动赋能,破除跨层级、跨部门办事“堵点、难点”,实现跨部门联动、协同审批的新模式,全力保障药械注册、生产、流通和使用全过程安全。
在广东省药监局牵头组织下,“港澳药械通”相关产品建立了全过程质量追溯管理体系。香港大学深圳医院作为“港澳药械通”试点医疗机构,探索建立了相关药品、医疗器械储存及使用管理的制度文件。同时,试点配送企业建立了专有管理标准和操作流程并形成体系。
据统计,通过粤港澳药品监管机制对接,优化对港澳已上市传统外用中成药内地上市注册审批流程,港澳药品内地注册的技术审评时间由原来的 200个工作日缩减至 80个工作日,审批总时限相应由原来的 235 个工作日减至115个工作日,审批时间压缩一半;上市后变更审批和再注册时限也分别减少 50个工作日,进一步压缩了审批时间,大大加快了港澳药品内地注册审评审批进程。
融入智慧监管体系“全国一盘棋”
目前,广东省共有药品生产许可证656张,含有分类码B的生产企业201家,纯B证企业121家,涉及跨省委托生产的有58家,跨省委托生产区域涉及20个省(区、市)。B证持有人跨省委托生产数量多、区域广、距离远等特点,给传统监管方式带来新的挑战。
2023年7月,国家药监局发布《关于加快推进省级药品智慧监管的指导意见》,提出各省级药监局要推动实现跨层级、跨地域的数据共享和业务协同,打造全国一体化综合监管体系。2023年9月发布的《国家药监局综合司关于开展药品智慧监管示范项目试点工作的通知》要求,开展药品委托生产跨省协同监管试点。
在国家药监局信息中心指导下,广东省药监局牵头,联合浙江、福建、海南、江西等地药监局,以药品跨省委托生产许可审批场景作为切口,依托国家药品智慧监管平台,建设双向接口,联通各省份智慧监管平台,建立统一、高效、畅通、透明的委托生产业务协同办理和协同监管制度与流程,助力打造“全国一盘棋”的智慧监管体系。
国家药监局组织开展药品智慧监管示范项目试点,利用信息化手段开展跨省协同监管,也将推动广东药品智慧监管向纵深发展。(陈海荣)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:常靖婕)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐