FDA黑框警告痛风药非布司他:增加死亡风险!
- 2019-02-23 21:03
- 作者:石公子
- 来源:药事纵横
此黑框警告是对 2017年11月15号美国食品药品监督管理局所发布的关于抗痛风药Uloric (非布司他片)心脏相关性死亡风险和全因死亡风险增高的药物安全通讯的最新更新。
2019年2月21日美国食品药品监督管理局(FDA)发布安全性警示公告称与抗痛风药物别嘌呤醇相比Uloric (非布司他片)会增加死亡风险。这一结论是基于对一项临床安全试验结果的深入审查所得出的,该试验发现:Uloric (非布司他片)会增加心脏相关性死亡风险和全因死亡风险。
因此,FDA正在更新Uloric (非布司他片)的处方信息,以发出黑框警告(FDA对上市药物采取的一种最严重的警告形式)和新的病人用药指南。同时FDA也在限制某些使用别嘌呤醇没有得到有效治疗或有严重副作用的患者对Uloric (非布司他片)的使用。
非布司他是2009年FDA批准的用于成年人治疗关节炎(痛风)的药品。痛风是体内尿酸物质堆积在一个或多个关节,并出现急性红肿、胀痛症状的疾病。非布司他通过降低血液中尿酸的水平来发挥作用。作为一种慢性疾病,在美国将近有830万成年人受痛风影响1,目前治疗痛风的药物有限,对治疗痛风的需要还未得到满足。

以下是FDA所发布的药物安全通讯中的一些内容
患者需知:患者若有心脏病史或卒中史,应告诉医务人员,并详细了解Uloric (非布司他片)治疗痛风的利弊。患者在服药期间出现以下症状,应立即寻求紧急医疗护理:
胸痛
气短
心跳加速或心律失常
单侧麻木或虚弱
头晕
说话困难
剧烈头痛
未经医嘱勿擅自停止药物服用,以免加剧病情
专业医务人员应确保只在别嘌呤醇治疗失败或不耐受别嘌呤醇的患者中使用Uloric(非布司他片),并咨询服用Uloric(非布司他片)的患者是否有心血管病史,并建议患者在出现以上症状时立即寻求医疗帮助。
FDA于2009年初次批准Uloric(非布司他片)上市时在当时的处方信息中已包含非布司他片关于心血管事件的警告和注意事项,并要求Uloric(非布司他片)的生产商武田制药公司开展大规模药物上市后安全性研究试验,试验是在使用非布司他和别嘌醇治疗痛风的6000例患者间开展的。主要终点是心脏相关性死亡,非致命性心脏病发作,非致命性中风以及需要手术干预的心脏供血不足的情况。
结果表明,总体而言,与别嘌呤醇相比,Uloric(非布司他片)并没有增加这些复合事件发生的风险,然而,当对终点分别进行评估时,Uloric(非布司他片)显示心脏相关性死亡和全因死亡的风险增加。在接受Uloric(非布司他片)治疗的患者中每年每1000例患者中有15例出现心脏相关性死亡而别嘌呤醇治疗患者中每年每1000例患者中有11例出现心脏相关性死亡。此外,服用非布司他每年每1000例患者中有26例全因死亡,而每1000名使用别嘌呤醇治疗一年的患者中有22例死亡。这项安全试验在2019年1月11日举行的公众咨询委员会外部专家会议上也进行了相关讨论。
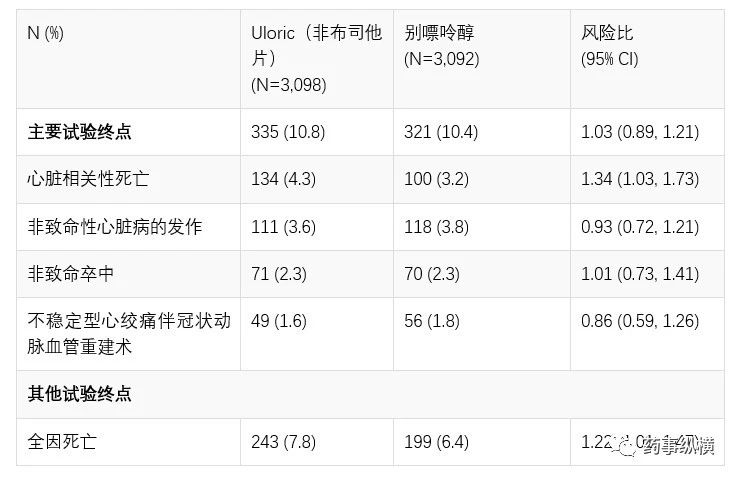
与报道相关的数据
1. ZhuY, Pandya BJ, Choi HK. Prevalence of gout and hyperuricemia in the US generalpopulation: The National Health and Nutrition Examination Survey 2007-2008.Arthritis Rheum 2011;63:3136-41
报道来源
https://www.fda.gov/Drugs/DrugSafety/ucm631182.htm
https://www.fda.gov/Drugs/DrugSafety/ucm584702.htm
注意:以上信息来自作者编译,药事纵横对内容进行了核实并表示中立
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:)
分享至
右键点击另存二维码!
-
相关阅读
- 药物警戒快讯第11期(总第199期)
-
为你推荐













