营养与健康所等开发出变形式碱基编辑新系统
- 2021-05-13 14:14
- 作者:
- 来源:中国科学院官网
5月10日,Nature Cell Biology在线发表了中国科学院上海营养与健康研究所研究员杨力课题组与合作者在碱基编辑研究领域发布的最新进展——Eliminating base-editor-induced genome-wide and transcriptome-wide off-target mutations。
碱基编辑器(base editor)主要是由两个主要的功能结构域组分组成,分别为识别基因组特定DNA序列定位的定位器(locator)和可对该特定基因组DNA序列(或者位点)进行编辑的效应器(effector)。其中,胞嘧啶碱基编辑系统主要以nCas9/sgRNA作为locater执行对编辑的识别和定位功能,以胞嘧啶脱氨酶APOBEC/AID作为effector执行胞嘧啶脱氨的功能并最终实现C-to-T的编辑。随着碱基编辑技术的不断开发,基因编辑效率和靶向范围显著提高,但在全基因组和/或全转录组水平仍存在大规模的脱靶效应,这限制了其在生物学和临床上的应用。
该研究中,研究人员首先发现了在胞嘧啶脱氨酶中天然存在的抑制序列结构域(deoxycytidine deaminase inhibitor,dCDI),并利用其开发出一系列可高效催化靶位点C-to-T编辑、抑制脱靶位点C-to-T编辑的新型碱基编辑系统,并依据其特性,命名为变形式碱基编辑系统(transformer base editors,简称tBEs)(图A)。结合高通量测序技术和计算生物学的研究方法,研究人员评估了tBE的编辑效率、脱靶效应和编辑产物纯度,结果显示,tBE碱基编辑系统可以在执行高效C-to-T编辑的同时,最大程度地减少由locator产生的Cas9/sgRNA依赖性脱靶效应(sgRNA-dependent off-target,OTsg)和effector产生的Cas9/sgRNA非依赖性单链DNA脱靶效应(sgRNA-independent single-stranded off-target,OTss)。此外,该研究还构建了在全基因组检测脱靶的计算分析流程BEIDOU(Base/Prime Editor Induced DNA Off-target site identification Unified toolkit,https://github.com/YangLab/BEIDOU)(图B),并结合全转录组RNA脱靶鉴定工具RADAR(RNA-editing Analysis-pipeline to Decode All twelve-types of RNA-editing events,https://github.com/YangLab/RADAR)(Wang et al. Cell Rep 2020),证明了tBE具有与本底水平类似的全基因组和全转录组突变效应,提示tBE可能不具有早期BE3的脱靶效应。另外,该研究成功地将tBE用于小鼠Pcsk9的编辑,通过引入终止密码子的方法降低了小鼠体内PCSK9的表达和LDL-C的水平。对编辑后小鼠进行全基因组和全转录组测序表明,tBE在in vivo水平同样仅产生与背景水平相一致的突变率。相关研究证明了tBE碱基编辑系统具有很好的特异性和安全性,提高了碱基编辑系统的应用价值,拓展了碱基编辑系统在点突变引起的疾病治疗中的应用前景。
杨力、上科大生命学院教授陈佳、武汉大学医学研究院教授殷昊和上科大免疫化学研究所教授杨贝为论文的共同通讯作者。杨力组博士生薛尉,陈佳研究组博士王丽洁(毕业生)和博士生高润泽、殷昊研究组博士后张红霞和硕博研究生邱厚圆为论文的共同第一作者。研究工作得到科学技术部、国家自然科学基金委、武汉大学、武汉市科技局、中科院青年创新促进会、教育部和博士后基金等项目的资助。
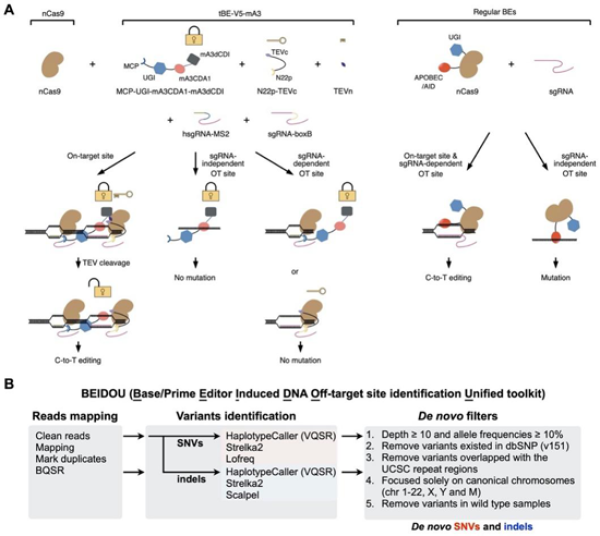
(A)tBE作用的原理示意图。以tBE-V5-mA3为例,其可在靶位点去除dCDI产生高效编辑效果,但在OTss和OTsg位点时由于dCDI的存在可以抑制非靶向突变。(B)BEIDOU计算分析流程评估碱基编辑的潜在全基因组水平脱靶
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐