舆情看点|2022年药品优先审评公示情况统计
- 2023-02-14 15:42
- 作者:
- 来源:中国食品药品网

自2020年新修订《药品注册管理办法》建立优先审评程序,《突破性治疗药物审评工作程序(试行)》《药品附条件批准上市申请审评审批工作程序(试行)》《药品上市许可优先审评审批工作程序(试行)》等文件发布以来,国家药监局持续优化药品上市注册制度,加快具有明显临床价值的药品上市速度。
本文根据药审中心优先审评公示信息,对2022年被纳入优先审评名单的药品进行统计分析。总体来看,2022年共70件药品(按受理号计)被药审中心纳入优先审评名单,较2021年的110件同比减少36%;覆盖49个品种(按药品名称计),较2021年的67种同比减少27%,如图1所示。
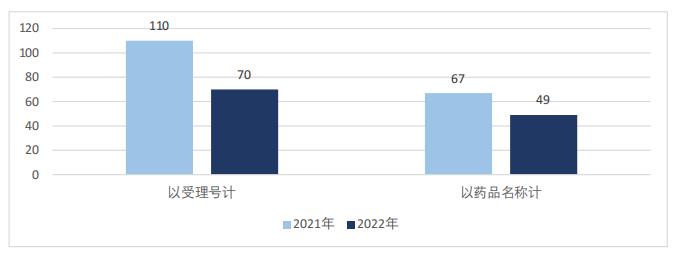
图1 2021~2022年优先审评药品数量
儿童用药数量居首,3种药品数量增长
按受理号统计,虽然2022年被纳入优先审评名单的药品总数相较于2021年有所减少,但是,突破性治疗药物、临床急需药品和疫苗产品数量有较大增长,儿童用药数量排名升至首位。如图2所示,2022年共23件符合儿童生理特征的新品种、剂型和规格儿童用药品,是2022年占比最高的拟优先审评理由;共18件纳入突破性治疗药物程序的药品,相较于2021年的11件同比增长64%;共16件临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药,相较于2021年的7件同比增长129%;疾病预防、控制急需的疫苗和创新疫苗共4件,相较于2021年的仅1件同比增长300%。而符合附条件批准的药品和其他优先审评审批的情形则大幅降低。
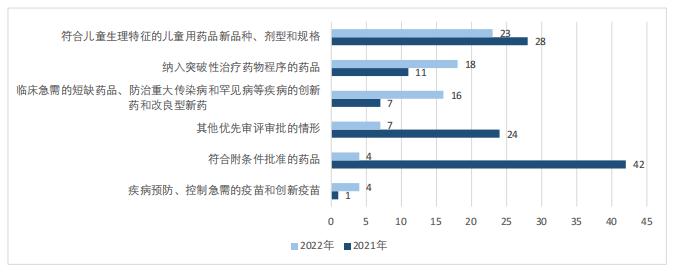
图2 2021~2022年拟优先审评理由
中药缺席优先审评,化药占据大半江山
如图3所示,2022年的优先审评名单中没有出现中药的身影,药品类型以化学药品为主,共53件,占比达到了76%;生物制品共17件,占比24%,其中,治疗用生物制品共13件,占比18%,预防用生物制品共4件,占比6%。
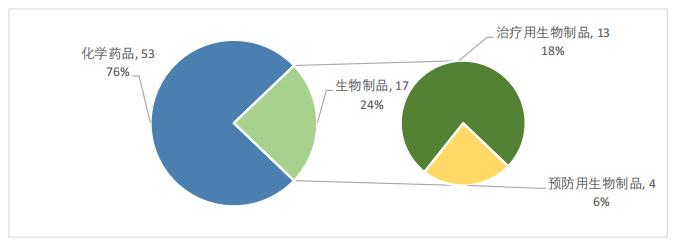
图3 2022年优先审评药品类型占比
创新药总数占比增加
从注册分类看,在化学药品中,5.1类药品最多,达到了22个,占比42%;3类药品次之,共14个,占比26%;2类药品共8个,其中,2.4类药品共5个,占比9%,2.2类药品1个,占比2%,2款药品同时属于2.2类和2.4类,占比4%;1类创新药共6个,占比11%;4类药品共3个,占比6%,如图4所示。
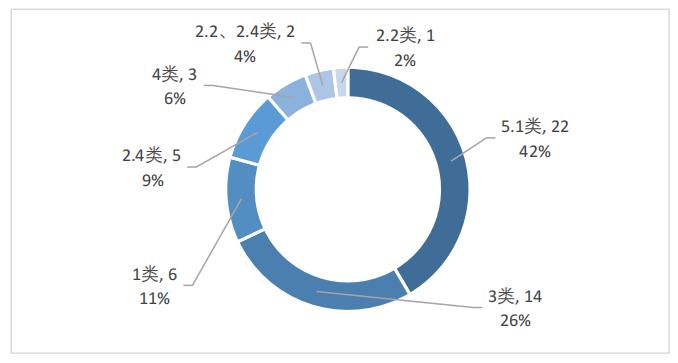
图4 2022年优先审评化学药品注册分类
生物制品中,治疗用生物制品以1类创新型生物制品为主,共6件,占比46%;2.2类和3.2类生物制品次之,各3件,分别占比23%;3.3类生物制品1件,占比8%,如图5所示。
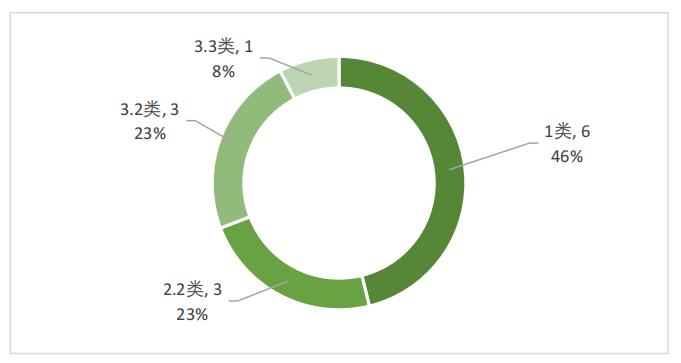
图5 2022年优先审评治疗用生物制品注册分类
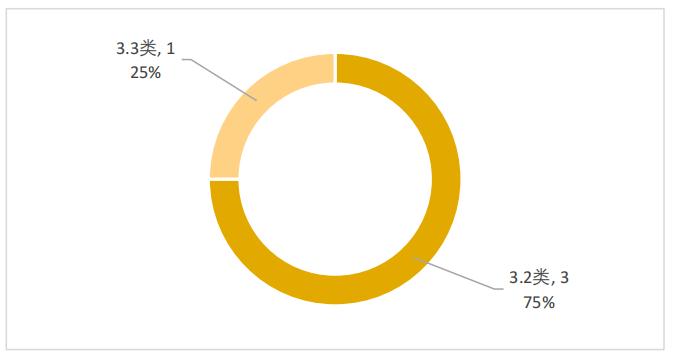
预防用生物制品包括3.2类疫苗3件和3.3类疫苗1件,分别占比75%和25%,如图6所示。
图6 2022年优先审评预防用生物制品注册分类
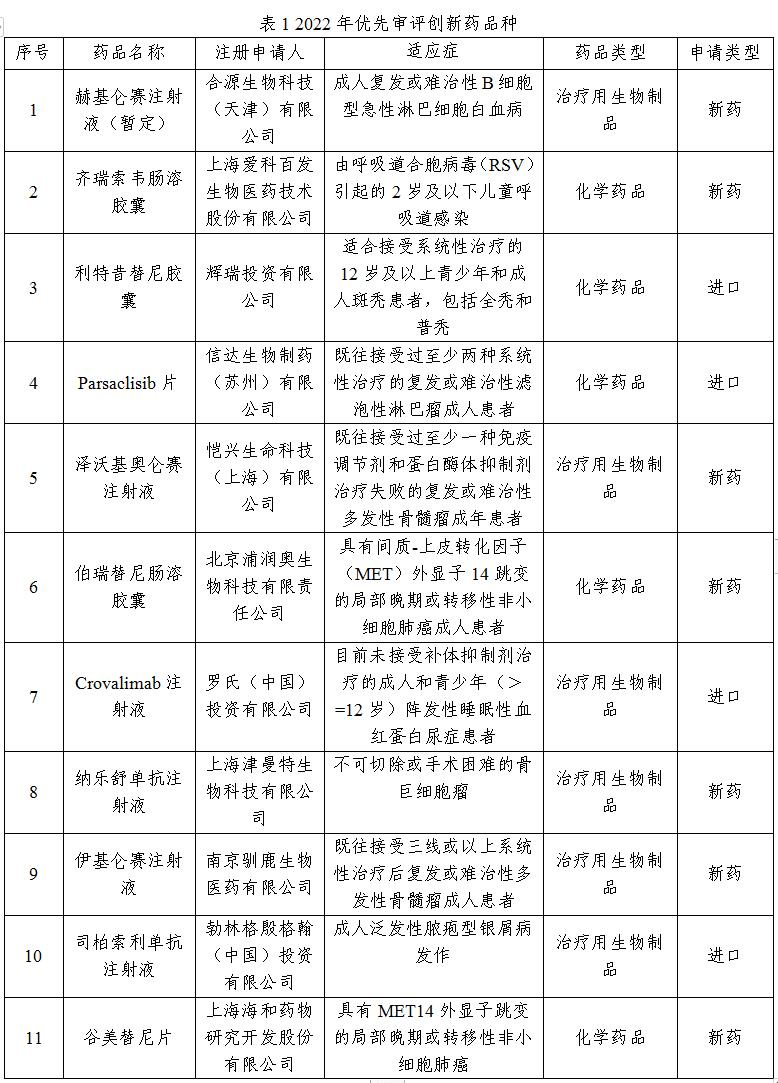
综上所述,2022年共12件创新药被纳入优先审评名单,覆盖11个品种,如表1所示。其中,包括5种化学药品和6种治疗用生物制品;4种创新药为进口药品,其他均来自本土药企。
本土药企包揽优先审评数量前三
2022年三家本土药企被纳入优先审评名单的药品数量名列前茅。其中,深圳市康哲生物科技有限公司凭借甲氨蝶呤注射液(预充式)丰富的规格,以7件优先审评药品的数量排名第一;祐儿医药科技(上海)有限公司在剂型和规格方面并重,凭借盐酸哌甲酯口服缓释干混悬剂和盐酸哌甲酯缓释咀嚼片共6件药品排名第二;成都苑东生物制药股份有限公司则凭借布洛芬注射液和甲硫酸新斯的明注射液共3件药品排名第三。其余还有11家药企有2件药品被纳入优先审评名单。
从2022年优先审评名单的情况看,在拟优先审评理由方面,国家药监局制定的一系列政策有效地引导企业以临床价值为导向研发药品,尤其促进了儿童用药的持续创新和发展;在药品类型方面,化学药品仍然是优先审评的主力军,中药则在名单中一药难求,仍需政策鼓励;在药品创新方面,本土药企创新能力不断提升,逐步在政策引导下实现创新转型。(内容由中国健康传媒集团舆情监测中心提供)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:张可欣)
分享至
右键点击另存二维码!
-
为你推荐
-

-
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有