每周医药看点(10月14日—10月20日)
- 2024-10-22 13:52
- 作者:张可欣
- 来源:中国食品药品网
中国食品药品网讯 《国家医疗保障局办公室关于规范医保药品外配处方管理的通知》发布,要求集中开展医保外配处方使用专项治理;国家药监局药品审评中心发布《放射性治疗药物申报上市临床风险管理计划技术指导原则(征求意见稿)》并公开征求意见……10月14日—10月20日,医药行业的这些动态值得关注。
行业·政策动态
1.国家卫生健康委、教育部、国家中医药局、国家疾控局四部门联合印发《医学人文关怀提升行动方案(2024—2027年)》(以下简称《行动方案》)。《行动方案》贯穿医学生培养全过程和医务人员职业全周期,主要内容包括医学生人文素养培育、医疗卫生机构人文关怀建设、崇高职业精神弘扬等3个方面。
2.国家医保局网站发布《国家医疗保障局办公室关于规范医保药品外配处方管理的通知》(以下简称《通知》),进一步规范医保药品外配处方管理。《通知》要求,集中开展医保外配处方使用专项治理,纸质处方使用量大的、单个处方开药剂量大的等5种情形必查。
3.国家药监局药品审评中心(CDE)发布《放射性治疗药物申报上市临床风险管理计划技术指导原则(征求意见稿)》并公开征求意见,征求意见时限为自发布之日起1个月。
4.CDE就《化学仿制药参比制剂目录(第八十七批)》(征求意见稿)公开征求意见,涉及康替唑胺片等药品。
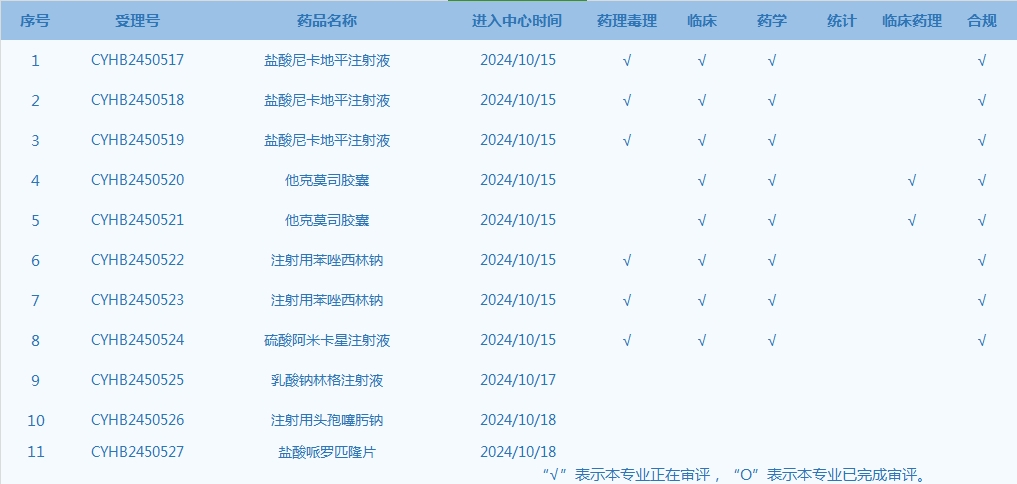
5.CDE网站公示11个仿制药一致性评价任务,涉及盐酸尼卡地平注射液等品种(截至10月20日)。
产品研发·上市信息
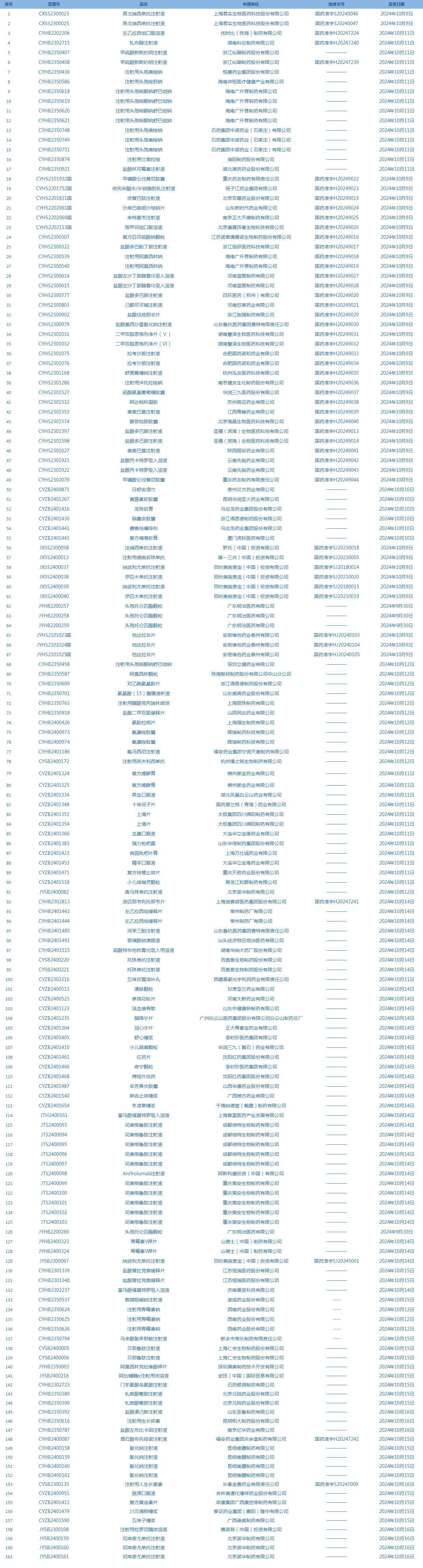
1.国家药监局发布5期药品批准证明文件送达信息,共包括161个受理号,涉及上海君实生物医药科技股份有限公司等企业(截至10月20日)。
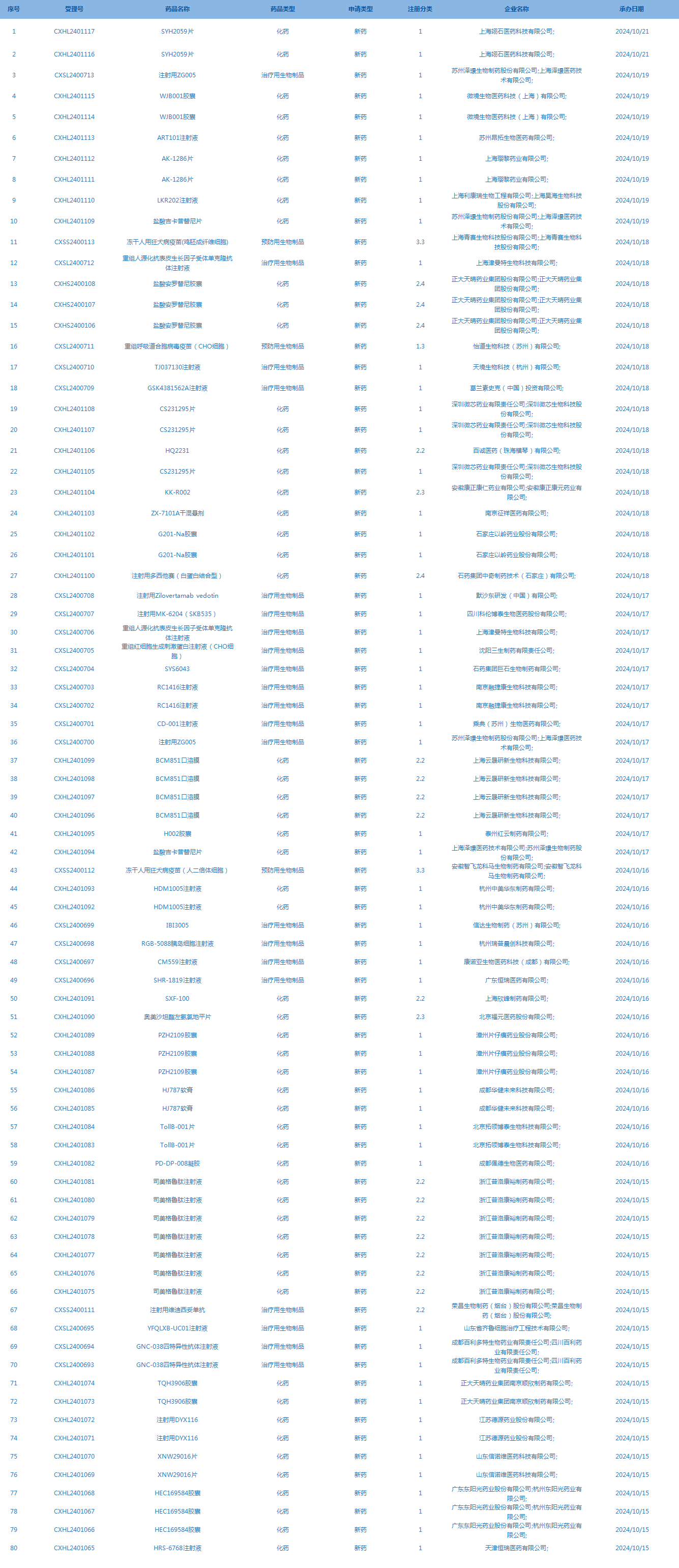
2.CDE承办受理80个新药上市申请,包括SYH2059片(截至10月20日)等。
3.华海药业发布公告称,近日收到美国FDA通知,公司申报的恩格列净二甲双胍片的新药简略申请已获得暂时批准。暂时批准指FDA已经完成仿制药的所有审评要求,但由于专利权或专卖权未到期而给予的一种批准形式。
4.德琪医药发布公告称,韩国食品医药品安全部已批准公司产品塞利尼索片联合硼替佐米和地塞米松用于治疗至少接受过一种先前治疗的多发性骨髓瘤(MM)成人患者的补充新药上市申请。此前,塞利尼索片已在韩国获批联合地塞米松用于治疗复发/难治性多发性骨髓瘤(R/R MM)和单药治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)两项适应证。本次是该产品在韩国获批的第三项适应证。
5.科兴制药发布公告称,公司合作伙伴浙江海昶生物医药技术有限公司于近日收到英国药品和健康产品管理局核准签发的关于科兴制药引进产品注射用紫杉醇(白蛋白结合型)的上市许可。
6.长春高新发布公告称,其子公司长春金赛药业有限责任公司GenSci122片项目已在FDA获得新药临床试验申请默示许可。
医药企业观察
1.百裕制药与诺华就一款小分子抗肿瘤药物签订独家许可协议。根据协议,百裕制药将收到7000万美元首付款,以及可达11亿美元的开发、注册及商业化等各类里程碑付款和相应特许使用费。诺华将获得该款小分子创新药的全球独家开发及商业化权利。
2.上海医药与拜耳健康消费品公司签署战略合作协议,双方将依托共同愿景和专业能力,整合各自在产业、营销及渠道等方面的优势携手发展。
3.丹诺医药宣布完成逾3亿元E轮融资的首批交割。这轮融资由中山投控旗下中山创投和AMR Action Fund(AMR基金)共同领投,所获资金用于支持核心新药研发管线,包括治疗幽门螺杆菌感染新药候选物TNP-2198和治疗植入医疗器械感染新药候选物TNP-2092的后期临床试验和商业化。
4.泽辉生物向中国港交所递交招股书,拟在香港主板上市,中金公司为保荐机构。
5.海森药业发布公告称,公司拟与东阳经开区管委会签署《海森药业新厂区建设项目(一期)投资合作协议》,拟在东阳经开区内投资海森药业新厂区建设项目,项目一期投资总额不低于20亿元人民币,用地约192.2亩,投资建设新厂区用于生产硫糖铝和阿托伐他汀钙等原料药。
6.山东博苑医药化学股份有限公司创业板上市注册生效,其保荐机构为中泰证券,拟募集资金66,819.04万元。
药品集中采购
1.三明采购联盟办公室发布《关于开展部分药品耗材产品信息采集工作的通知》。此次纳入信息采集的药品包括白介素-11注射剂、环孢素口服常释剂型等21种药品,以及4种医用耗材。
2.山西省药械集中招标采购中心发布关于报送第十批国家组织药品集中采购品种需求量的通知。通知显示,根据相关文件精神,按照国家集采部署要求,该省将组织医疗机构开展第十批国采报量工作。根据报量药品清单,此次报量包括263个品规。(本报记者张可欣整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:周雨同)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐