近期中美欧批准上市新药盘点 我国自主研发的四款新药在全球范围内首次获批上市
- 2026-02-05 09:14
- 作者:陈倩
- 来源:中国医药报
2025年12月份中美欧批准上市的新药中,中国批准上市的新药数量最多,为8款;美国批准7款;欧盟批准1款新药上市。
中国批准八款新药上市
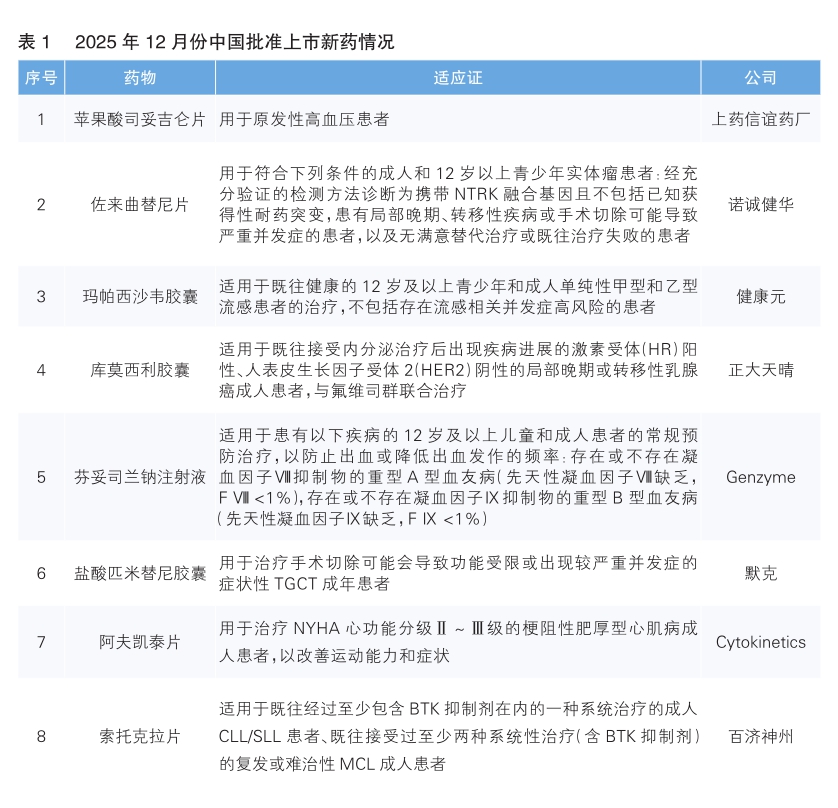
2025年12月份,我国共批准8款新药上市。根据Pharmadigger数据库,其中佐来曲替尼片、库莫西利胶囊、盐酸匹米替尼胶囊和索托克拉片为我国企业自主研发的全球范围内首次获批上市的新药(详见表1)。
苹果酸司妥吉仑片(商品名:信妥安)是上药信谊药厂与日本田边三菱制药株式会社合作研发的新一代口服非肽类小分子肾素抑制剂,获批用于原发性高血压的治疗。该药通过直接抑制肾素活性,拮抗由肾素-血管紧张素-醛固酮系统(RAAS)过度激活所致的血压升高。其化学结构经计算机辅助药物设计和多轮结构优化,显著提升了对肾素的结合亲和力,同时降低了与其他蛋白酶的交叉反应,从而减少脱靶效应。该药本次获批基于一项Ⅲ期临床试验结果,该试验共纳入828名轻中度高血压患者,每日1次口服100mg司妥吉仑,连续用药12周。试验结果显示,司妥吉仑可显著降低患者坐位平均舒张压,降幅较阳性对照药呈非劣效,且在部分亚组中展现出优效趋势。
佐来曲替尼片(商品名:宜诺欣)是诺诚健华自主研发的新一代TRK抑制剂,采用每日1次、每次2片的口服给药方式,用于治疗携带神经营养酪氨酸受体激酶(NTRK)融合基因的成人和12岁以上青少年实体瘤患者。与第一代TRK抑制剂相比,佐来曲替尼疗效更优,可实现长期、深度的疾病缓解,且血脑屏障穿透性强、整体安全性良好。同时,相关研究数据证实,该药可克服第一代TRK抑制剂带来的耐药问题。其本次获批主要基于一项关键性试验结果:试验患者总缓解率为89.1%,疾病控制率为96.4%;24个月无进展生存率为77.4%,24个月总生存率为90.8%。
玛帕西沙韦胶囊(商品名:壹立康)为新型帽依赖性核酸内切酶(CEN)抑制剂,最早由太景医药及太景生物研发。2023年3月,太景医药及太景生物与健康元签署了一项授权协议,健康元由此获得该药在指定范围内的独家开发、制造及商业化权利。临床早期研究数据显示,玛帕西沙韦具有起效快、抗病毒作用持久、耐受性良好、口服不受食物影响等特点,可同时有效抑制甲型、乙型流感病毒。其Ⅲ期临床研究结果显示,玛帕西沙韦治疗组与安慰剂组的所有流感症状缓解中位时间分别为60.9小时和87.9小时,治疗组较安慰剂组缩短27小时,研究达到主要疗效终点且差异具有统计学意义;针对乙型流感患者,治疗组的所有流感症状缓解中位时间较安慰剂组进一步缩短至31小时。
库莫西利胶囊(商品名:赛坦欣)是正大天晴自主研发的新型细胞周期蛋白依赖性激酶2/4/6(CDK2/4/6)抑制剂,对CDK2、CDK4、CDK6均具有不同程度的抑制作用,且对CDK4的精准抑制能力更强。其强大的抑制活性作用,可能有助于在临床上克服现有CDK4/6抑制剂的耐药问题。该药本次获批主要基于其Ⅲ期临床试验结果:库莫西利联合氟维司群治疗组患者的中位无进展生存期为16.6个月,较对照组延长9.2个月;该联合治疗方案可将患者的疾病进展/死亡风险降低64%(HR=0.36)。
芬妥司兰钠注射液(商品名:赛菲因)是Genzyme公司研发的小干扰RNA创新非因子疗法。该药每年最少仅需6次皮下注射,可通过预充注射笔或西林瓶配合注射器给药,能为患者提供持续稳定的凝血保护。其治疗原理为通过降低抗凝血酶水平,促进凝血酶生成增多,从而改善血友病患者的凝血功能。该药本次获批主要基于ATLAS Ⅲ期临床研究数据,相较于按需治疗方案,接受芬妥司兰钠注射液治疗的患者(无论是否伴有抑制物)均显示出显著疗效。其中,合并抑制物患者的平均年化出血率(ABR)降低73%,无抑制物患者ABR降低71%。该药最早于2025年3月份在美国获批上市。
盐酸匹米替尼胶囊(商品名:贝捷迈)是和誉医药独立研发的一款新型口服、高选择性且高效的小分子CSF-1R抑制剂。2023年12月,和誉医药与默克就该药签订独家许可协议。根据协议条款,默克获得匹米替尼在大中华区所有适应证的独家商业化授权,并拥有其全球商业化权利的独家选择权。该药本次获批基于一项治疗腱鞘巨细胞瘤(TGCT)的Ⅲ期MANEUVER研究,该研究达到主要终点:患者在第25周的客观缓解率达54%,而安慰剂组仅为3.2%。
阿夫凯泰片(商品名:星舒平)是Cytokinetics公司自主研发的小分子心肌肌球蛋白抑制剂,用于治疗纽约心脏协会(NYHA)心功能分级Ⅱ~Ⅲ级的梗阻性肥厚型心肌病成人患者,以改善运动能力和症状。该药通过全面的化学优化,实现治疗指数与药代动力学特征的双重改善。其作用机制为减少每个心动周期中活性肌球蛋白产力横桥的数量,进而抑制与肥厚型心肌病相关的心肌过度收缩。该药本次获批基于其Ⅲ期SEQUOIAHCM研究的积极结果,数据显示,阿夫凯泰片治疗组患者运动能力获显著提升,经心肺运动测试测得的峰值氧气摄取量(pVO2)较基线增加1.8 mL/(kg·min)。该药本次在中国和美国同步获批上市。
索托克拉片(商品名:百悦达)是百济神州自主研发的高选择性BCL-2抑制剂,其分子设计旨在实现更深层次、更持久的靶点抑制。据百济神州披露,与维奈克拉相比,索托克拉在临床前研究和肿瘤模型中显示出更高的效力和靶点选择性,且具备克服耐药性的潜在可能。该药本次获批基于其在复发难治性慢性淋巴细胞白血病(CLL) / 小淋巴细胞淋巴瘤(SLL)和复发难治性套细胞淋巴瘤(MCL)患者中开展的BGB-11417-202试验结果:经独立审查委员会确认的患者客观缓解率达80.5%,完全缓解或完全缓解伴骨髓造血不完全恢复率为26.8%,体现出迅速且深度的缓解获益;患者12个月时的缓解持续时间无事件率为84.7%。
美国批准七款新药上市
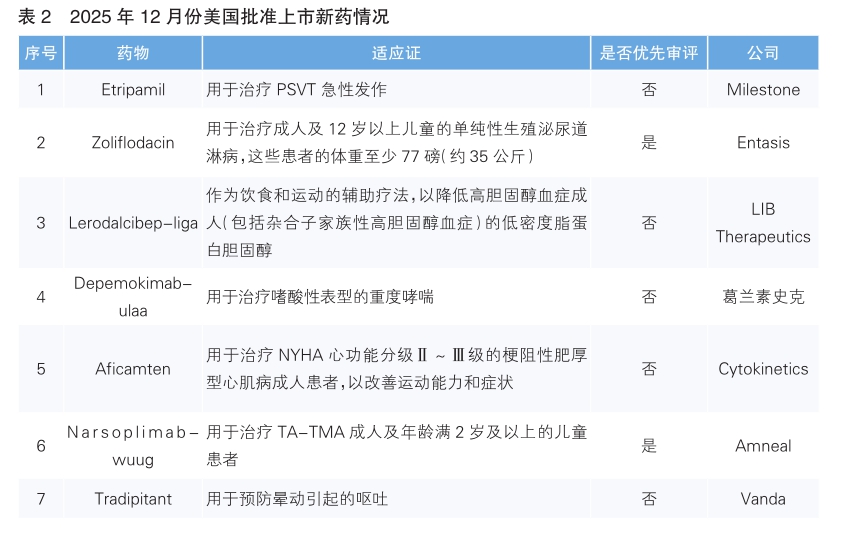
2025年12月份,美国批准上市7款新药。根据Pharmadigger数据库,7款新药均为全球范围内首次获批(详见表2)。
Etripamil(商品名:Cardamyst)是Milestone公司研发的速效非二氢吡啶类L型钙通道阻滞剂(CCB)。作为鼻喷雾剂,Etripamil可由患者自主按需给药,适用于高度症状性、发作不可预测的阵发性室上性心动过速(PSVT)的急性治疗。该药本次获批主要基于其涵盖超 1800 名患者、累计超2000次PSVT发作的临床研究数据与安全性数据,其中包括全球多中心、随机、双盲的Ⅲ期RAPID临床试验。研究分析证实,与安慰剂相比,Etripamil更有可能使症状性PSVT发作恢复为窦性心律。且RAPID试验达到主要终点:患者自行给药后30分钟内,Etripamil治疗组的窦性心律转复率达64%,安慰剂组仅为31%。
Zoliflodacin(商品名:Nuzolvence)是Entasis公司研发的首款螺嘧啶三酮类口服Ⅱ型拓扑异构酶抑制剂,具有独特的作用机制。既往体外研究数据表明,该药对淋病奈瑟菌的多重耐药菌株(包括对头孢曲松和阿奇霉素耐药的菌株)均具有抗菌活性,且不会与其他类别抗生素产生交叉耐药性。该药本次获批主要基于一项关键Ⅲ期临床研究,该研究共入组930名单纯性生殖泌尿道淋病患者。研究中,三分之二的患者接受单次3克Zoliflodacin溶于水后的口服给药,剩余三分之一患者接受“头孢曲松注射+阿奇霉素口服”的标准治疗,研究主要评估患者治疗后第4至第8天的细菌清除效果。结果显示,Zoliflodacin治疗组的临床有效率达91%,标准治疗组为96%,提示Zoliflodacin的疗效与标准治疗方案相当。
Lerodalcibep-liga(商品名:Lerochol)是LIB Therapeutics研发的一款新型蛋白结合的第三代PCSK9抑制剂,用于帮助患者达到并维持低密度脂蛋白胆固醇(LDL-C)目标值。该药每月仅需皮下注射1次,单次注射剂量低,且在室温条件下可稳定保存长达3个月,患者可自主选择注射时间与部位。该药本次获批主要基于其全球Ⅲ期LIBerate临床试验数据,该试验共纳入2900余名患者,包括确诊动脉粥样硬化性心血管疾病/ 极高危人群、高 / 极高危非心血管疾病人群,以及杂合子/纯合子家族性高胆固醇血症患者。研究分为两个阶段,关键安慰剂对照试验阶段为每月给药1次、持续治疗52周;随后2400余名患者进一步入组72周开放标签扩展研究。结果显示,Lerodalcibep可使心血管疾病患者或极高危心血管疾病人群的LDL-C水平持续降低≥60%,并使杂合子家族性高胆固醇血症患者的LDL-C水平持续降低 ≥50%。该药整体耐受性良好,在长期扩展研究中,未报告与治疗相关的严重不良事件。
Depemokimab-ulaa(商品名:Exdensur)是葛兰素史克研发的新一代抗白介素5(IL-5)单克隆抗体,经分子结构优化实现半衰期显著延长,同时兼具高靶点结合亲和力与强效生物活性,临床仅需每半年皮下注射1次。IL-5是2型炎症中的关键细胞因子,这类炎症可通过血嗜酸性粒细胞计数识别,也是多种炎症性疾病的重要致病驱动因素。在难治性哮喘患者中,多数存在该类炎症,且易引发疾病急性加重,增加患者住院风险;而高达85%的慢性鼻窦炎伴鼻息肉患者同样合并2型炎症,且其炎症水平与疾病严重程度、临床症状表现密切相关。该药本次获批基于两项Ⅲ期临床研究(SWIFT-1和SWIFT-2)的积极结果:治疗52周后,Depemokimab组患者的哮喘发作频率较安慰剂组显著降低。
Aficamten(商品名:Myqorzo)是Cytokinetics公司研发的新一代选择性小分子心肌肌球蛋白抑制剂。该药2025年12月份已在中国同步获批上市。
Narsoplimab-wuug(商品名:Yartemlea)是Amneal公司研发的一款靶向MASP-2的全人源单克隆抗体。MASP-2是补体凝集素通路的效应酶,属于创新的促炎性蛋白靶点。值得注意的是,抑制MASP-2已被证实可保留抗体依赖性经典补体激活通路的完整功能,而该通路正是机体获得性免疫应答的关键构成部分。该药本次获批主要基于一项针对造血干细胞移植相关血栓性微血管病(TA-TMA)成人患者的单臂临床试验,其疗效评估指标为血栓性微血管病(TMA)完全缓解,具体定义为TMA关键实验室指标(血小板计数及乳酸脱氢酶水平)改善,同时伴随器官功能改善或脱离输血依赖。试验结果显示,共有61%的入组患者达到完全缓解标准。
Tradipitant(商品名:Nereus)是Vanda公司研发的口服神经激肽-1(NK-1)受体拮抗剂,可通过强效且选择性地拮抗NK-1受体,直接作用于疾病关键通路以发挥治疗作用。该药本次获批主要基于3项关键性临床试验,其中包括2项在船上开展的Ⅲ期真实世界诱发研究(Motion Syros和Motion Serifos),以及1项支持性研究。研究结果显示,在Motion Syros研究中,Tradipitant治疗组患者的呕吐发生率为18.3%~19.5%,安慰剂组为44.3%;在Motion Serifos研究中,Tradipitant治疗组患者的呕吐发生率为10.4%~18.3%,安慰剂组为37.7%,整体风险降低幅度为50%~70%。
欧盟批准一款新药上市
2025年12月份,欧盟批准1款新药上市。根据Pharmadigger数据库,该药并非全球首次获批(详见表3)。
Rilzabrutinib(商品名:Wayrilz)是赛诺菲研发的一款口服、可逆的布鲁顿酪氨酸激酶(BTK)共价抑制剂,用于治疗对免疫球蛋白、抗D疗法或糖皮质激素应答不佳的持续性或慢性免疫性血小板减少症(ITP)。该药通过可逆共价抑制 BTK,一方面阻断B细胞受体(BCR) 信号通路、减少抗血小板自身抗体生成,另一方面同时抑制巨噬细胞FcγR信号通路,阻止其对抗体包被血小板的吞噬清除;且其可逆结合的设计可保留血小板正常聚集功能,降低出血风险。该药最早于2025年8月份在美国获批上市。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐