每周医药看点(2月24日—3月2日)
- 2025-03-06 08:56
- 作者:刘鹤
- 来源:中国食品药品网
中国食品药品网讯 国家短缺药品供应保障工作会商联动机制全体会议在京召开;国家药监局药品审评中心(CDE)将启动“儿童抗肿瘤药物研发鼓励试点计划”……2月24日—3月2日,医药行业的这些动态值得关注。
行业政策及药监动态
1.国家短缺药品供应保障工作会商联动机制全体会议在京召开,会议系统总结回顾2024年短缺药品保供成效,共商共议新的形势任务和2025年重点事项。国家卫生健康委作为国家联动机制牵头单位报告了工作总体进展,工业信息化部、商务部、市场监管总局、国家医保局、国家药监局分别报告了具体工作进展和下一步工作安排。
2.国家药监局发布公告,批准太阳升(亳州)生物医药科技有限公司的关黄母颗粒、江苏康缘阳光药业有限公司的参乌益肾片为首家中药二级保护品种,保护品种编号分别为ZYB2072025004、ZYB2072025005。
3.CDE发布通知明确,将启动“儿童抗肿瘤药物研发鼓励试点计划”,即“星光计划”(SPARK计划,Support Anti-tumor drugs R&D for Kids),并对“星光计划”的申报指南、申请表和实施框架公开征求意见。
4.CDE发布通知明确,将乙磺酸尼达尼布软胶囊纳入《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》试点项目,计划在中国开展上市后研究,整合定性研究和定量研究的混合研究方法,收集患者体验数据。
5.全国首部对药品和医疗器械研发、生产、经营使用进行全面规范的地方性法规——《上海市药品和医疗器械管理条例》于3月1日起正式施行。该条例共七章54条,通过临床试验阶段可以申请药品生产许可证、优化进口及市外医疗器械本地转产程序等举措,加速产品生产落地;通过优化进口罕见病药品检验用量、允许符合要求的商业规模批次药品进口销售等,助推产品快速上市销售,满足群众用药需求。
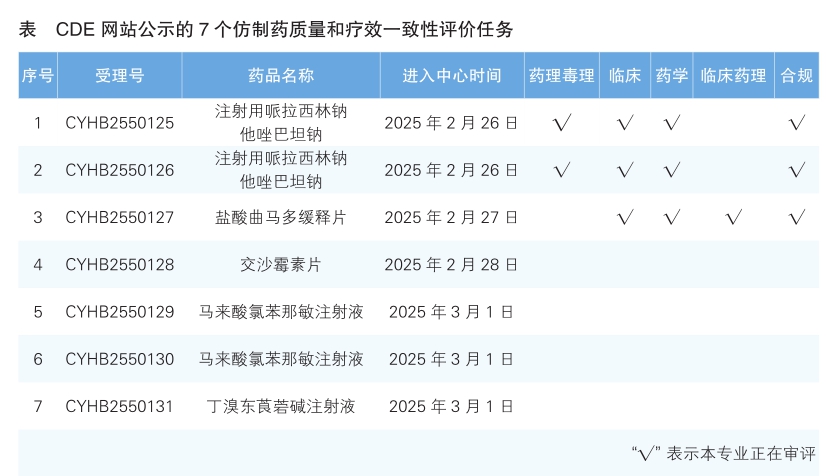
6.CDE网站公示7个仿制药一致性评价任务,涉及注射用哌拉西林钠他唑巴坦钠等品种。
产品研发上市信息
1.国家药监局发布5期药品批准证明文件送达信息,共包括249个受理号,涉及上海朝晖药业有限公司等企业。
2.CDE承办受理37个新药上市申请,包括IMB071703注射液等。
3.华东医药宣布,公司全资子公司杭州中美华东制药有限公司自主研发的注射用HDM2005的套细胞淋巴瘤(MCL)适应证获得美国食品药品管理局(FDA)孤儿药资格认定。
4.三迭纪宣布,公司3D打印胃滞留药物产品T20G的新药临床试验(IND)申请获FDA批准。T20G用于降低非瓣膜性房颤患者的卒中和全身性栓塞风险,采用三迭纪创新的熔融挤出沉积联合微注射成型工艺,并基于3D微结构胃滞留平台开发。
5.士泽生物宣布,公司自主开发的通用型诱导多能干细胞(iPSC)衍生亚型神经前体细胞注射液产品XS-228注射液,用于治疗肌萎缩侧索硬化(ALS)的IND申请获FDA批准。
医药企业观察
1.赛生药业宣布,公司就成纤维细胞生长因子受体(FGFR)选择性酪氨酸激酶抑制剂tasurgratinib succinate与卫材株式会社达成授权许可协议。该协议授予赛生药业在中国对 tasurgratinib succinate进行独家开发和商业化的权益。根据协议,赛生药业将向卫材株式会社支付预付款,根据开发进展、监管批准情况支付里程碑款项,并在产品上市后根据销售额支付销售里程碑款项以及一定比例的特许权使用费。
2.富祥药业宣布,公司以自有资金设立富祥(富裕)生物科技有限公司,注册资本为5000万元。设立的新公司已完成工商注册登记手续,经营范围涵盖食品销售、药品进出口等。
3 依诺基科宣布,公司顺利完成近1.5亿元A轮融资,本轮融资由弘盛资本、张江浩珩领投,合肥产投、飞图创投跟投,信成基金追加投资。本轮融资完成后,公司将持续强化技术平台建设,加速推动AI大模型等技术在酶挖掘及优化、发酵过程优化及放大等核心环节的实施应用,进一步提高研发效率。
4.康方生物宣布,公司自主研发的PD-1/ VEGF双抗依沃西的国际市场开发合作伙伴Summit Therapeutics已与辉瑞达成临床试验合作,共同推进依沃西与辉瑞多款抗体偶联药物在多种实体瘤中的联合治疗应用。辉瑞将全面负责本次合作的系列临床试验的开展,Summit Therapeutics将提供依沃西用于该系列临床试验,双方共同监督临床研究的进行。
药品集中采购
河北省医用药品器械集中采购中心对河北省国家、联盟(省)集采到期接续药品及京津冀赣集中带量采购化学药品部分拟中选结果进行公示。本批国家、联盟(省)集采到期接续采购围绕萘丁美酮胶囊等品种产生62个拟中选结果;京津冀赣集中带量采购产生3个拟中选结果,包含国药集团国瑞药业有限公司的注射用赖氨匹林等。(刘鹤整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:周雨同)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐