7月份美国Clinicaltrial数据库临床试验数据显示—— 泛糖尿病领域药物研发最为活跃
- 2025-09-04 14:38
- 作者:陈宇哲
- 来源:中国医药报
根据美国Clinicaltrial数据库数据,今年7月份,全球新开由企业资本主导的临床试验总数为723项,数量较6月份下降6.47%;单月新开临床试验数量高于去年同期水平,同比上升9.21%。泛糖尿病为7月份最热研发领域。
热门领域分布
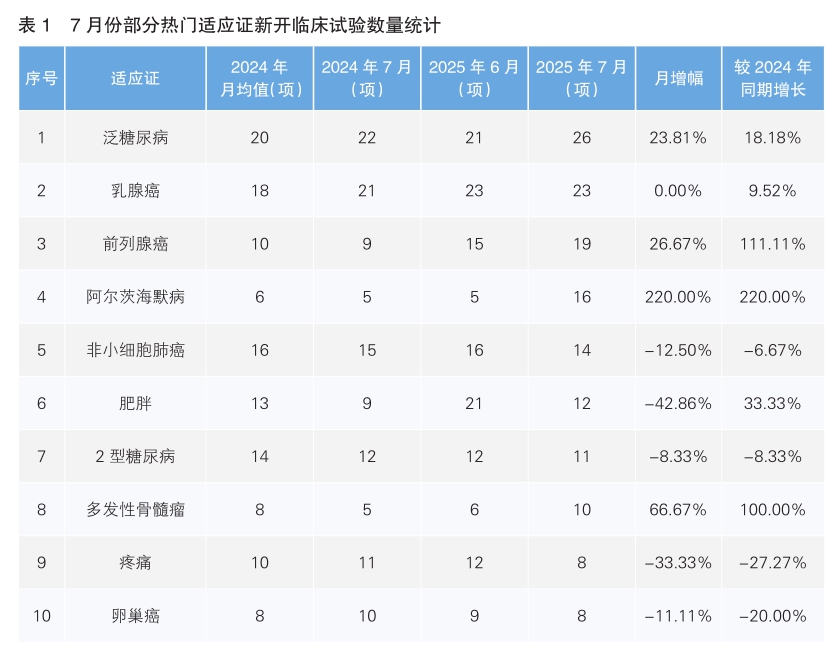
从7月份新开临床试验热门适应证来看,泛糖尿病为最主要的热门研发领域,新开临床试验26项,环比上涨23.18%,同比上涨18.18%。其次为乳腺癌,新开临床试验数量与6月份持平,与去年同期相比上涨9.52%。值得注意的是,7月份新开临床试验数量上升幅度最大的热门适应证为阿尔茨海默病,由6月份的5项上升至16项,上升幅度为220.00%;数量下降幅度最大的适应证为肥胖,由6月份的21项下降到12项,下降幅度为42.86%。(详见表1)
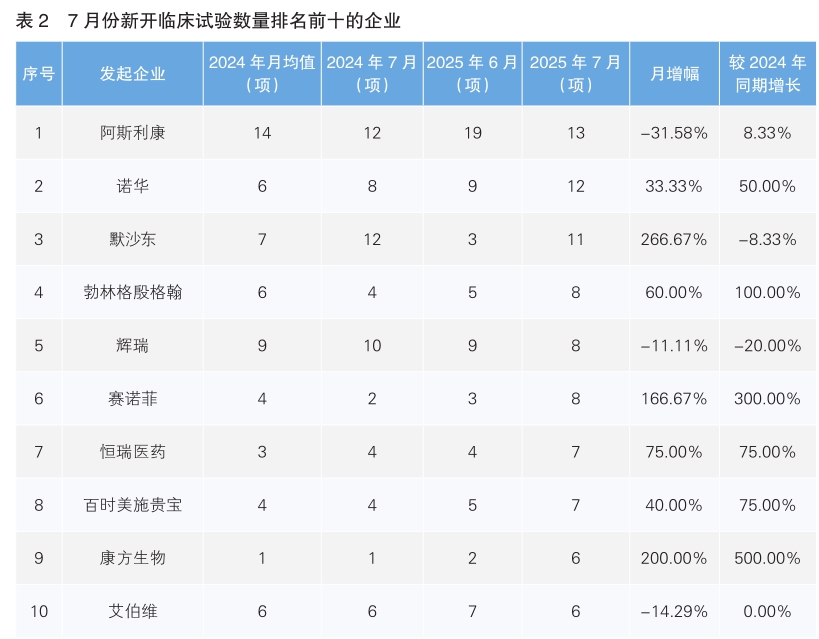
对新开临床试验的发起企业进行统计后发现,7月份发起临床试验最多的企业为阿斯利康,新开临床试验13项,环比下降31.55%,同比上升8.33%。其次为诺华,新开临床试验12项,环比上涨33.33%,同比增长50%。新开临床试验数量上升幅度最大的企业为默沙东,与6月份相比上升了266.67%。值得注意的是,我国药企恒瑞医药和康方生物7月份分别新开7项和6项临床试验,进入新开临床试验数量排名前十榜单。(详见表2)
对临床试验的申请国家和地区进行统计后发现,7月份美国仍为临床试验开展最为主要的国家,新开临床试验217项,相较6月份下降了6.06%。其次是中国,新开临床试验数量为95项。7月份新开临床试验数量月增长幅度最大的是加拿大,由6月份的9项增长至19项,增长幅度为111.11%。
头部企业表现
7月份新开临床试验数量排名前三的企业分别为阿斯利康、诺华和默沙东,数量分别为13项、12项、11项。
阿斯利康7月份新开的13项临床试验中,有3项为Ⅲ期临床试验,适应证均为肿瘤。其中一项的适应证为前列腺癌(NCT06952803),试验药物为Saruparib。该药是一种新一代PARP1选择性抑制剂,主要作用是抑制肿瘤细胞的DNA修复能力。另一项Ⅲ期临床试验的适应证为晚期透明细胞肾细胞癌(NCT07000149),试验药物为Volrustomig,该药是一种新型PD-1/CTLA-4双特异性抗体。剩余一项Ⅲ期临床试验的适应证为子宫内膜癌(NCT07044336),试验药物为Puxitatug samrotecan。该药作为一种靶向B7-H4的拓扑异构酶1抑制剂抗体偶联药物(ADC),在癌症治疗领域备受关注。
诺华7月份新开的12项临床试验中,有5项为Ⅲ期临床试验,其中两项的试验药物均为Remibrutinib,适应证分别为慢性自发性荨麻疹(NCT06868212)和复发性多发性硬化症(NCT06846281)。Remibrutinib是一种口服BTK抑制剂,主要通过抑制BTK级联反应减少组胺释放,缓解瘙痒、风团等症状。另有一项Ⅲ期临床试验的适应证为前列腺癌(NCT06855277),试验药物为AAA817,该药是一款靶向前列腺特异性膜抗原(PSMA)的放射性核素偶联药物(RDC)。还有一项Ⅲ期临床试验的适应证为肾病(NCT06858319),试验药物为Zigakibart。该药是一种人源化I gG4单克隆抗体,可特异性结合增殖诱导配体(APRIL),抑制B细胞及浆细胞产生抗体,从而对I gA肾病起到治疗作用。剩余一项Ⅲ期临床试验的适应证为夜间发作性血红蛋白尿症(NCT06934967),试验药物为Iptacopan。公开信息显示,该药是诺华研发的首个口服补体系统调节因子B靶向抑制剂,通过抑制B因子阻断旁路途径放大循环,用于治疗补体驱动型肾病。
默沙东7月份新开的11项临床试验中,有3项为Ⅲ期临床试验。其中一项适应证为结直肠癌(NCT06997497),试验药物为MK-1084,该药是一款为治疗KRAS G12C突变型肿瘤而设计的抑制剂。另一项Ⅲ期临床试验的适应证为乳腺癌(NCT07060807),试验药物为Patritumab deruxtecan。该药是一种靶向HER3的ADC药物,由全人源化抗HER3 IgG1单克隆抗体与拓扑异构酶Ⅰ抑制剂通过可切割四肽接头连接而成。剩余一项Ⅲ期临床试验的适应证为艾滋病病毒(HIV)感染(NCT07044297),试验药物为MK-8527,该药是一种HI V抑制剂和核苷逆转录酶易位抑制剂(NRTTI)。
恒瑞医药7月份新开的7项临床试验中,包含一项Ⅱ期临床试验、两项Ⅰ/Ⅱ期临床试验、4项Ⅰ期临床试验。其中,Ⅱ期临床试验的适应证为小儿手术镇静(NCT07036419),试验药物为注射用甲苯磺酸瑞马唑仑。该药是恒瑞医药自主研发的1类创新麻醉镇静药,通过激动GABAA受体发挥镇静作用,属于苯二氮艹卓类药物。该药最早于2019年12月在我国获批用于常规胃镜检查的镇静。两项Ⅰ/Ⅱ期临床试验的适应证分别为晚期实体瘤(NCT07070349)和前列腺癌患者正电子发射断层显像(PET)(NCT07056439),试验药物分别为HRS-6213和HRS-1738。4项Ⅰ期临床试验中,有两项试验药物均为HRS-8427,试验对象均为健康志愿者;另外两项Ⅰ期临床试验中,一项试验对象为健康志愿者,试验药物为HR091506(NCT07076459),另一项试验对象为2型糖尿病患者,试验药物为SHR-3167。
康方生物7月份新开的6项临床试验中,包含一项Ⅲ期临床试验、一项Ⅱ期临床试验和4项Ⅰ期临床试验。Ⅲ期临床试验的适应证为胃和胃食管交界处(GEJ)腺癌(NCT07023315),试验药物为Cadonilimab,该药是一种靶向PD1/CTLA4的IgG1支架Fc工程人源化双特异性抗体。Ⅱ期临床试验的适应证为肝细胞癌(NCT07052253),试验药物为Tinengotinib。公开信息显示,该药是一款全球首创的多靶点激酶(MTK)抑制剂,通过靶向FGFR/VEGFR、JAK和Aurora激酶三大关键通路,精准抑制肿瘤细胞增殖、血管生成及免疫逃逸。
(数据来源于美国Clinicaltrial数据库,统计时间为8月5日)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐