从“数量积累”转向“质量提升” ——上半年我国医疗器械获FDA认证情况分析
- 2025-09-04 10:16
- 作者:程瑾 郭韵婷 许佳锐
- 来源:中国医药报
美国食品药品管理局(FDA)认证是医疗器械进入国际市场的“通行证”,直接反映了医疗器械产品的技术实力与全球竞争力。今年上半年,我国医疗器械产品获得FDA认证的数量持续突破,产品结构、所属企业地域分布等也呈现新特征——普通和整形外科领域获证产品数量最多;Ⅱ类医疗器械占据主导地位;珠三角、长三角区域是我国医疗器械出海的核心枢纽。
获证数量持续增长 三大领域获证产品数量较多
今年上半年,我国医疗器械获得FDA认证的总数达264项,较2024年上半年的257项增长2.72%,较2023年上半年的241项增长9.5%。这一增长不仅是数量的累积,更反映了我国医疗器械企业对国际法规的良好适应能力,以及我国医疗器械产品的质量稳定性已得到国际认可,彰显出国产医疗器械出海的强劲势头。
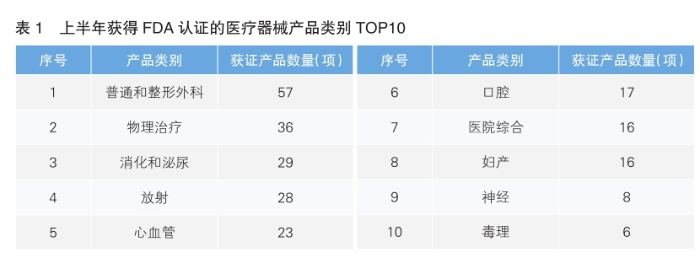
从产品应用领域来看,今年上半年普通和整形外科领域获证产品数量最多,为57项,主要受益于全球老龄化带来的关节置换、创伤修复需求,以及医美市场的快速增长。紧随其后的是物理治疗领域,获证产品为36项,反映出当下康复医疗需求的持续释放。消化和泌尿领域获证产品为29项,位列第三,这与慢性病管理、微创手术技术普及密切相关。
此外,放射、心血管领域分别以28项、23项,位列第四、第五位,体现出国产高端设备(如影像设备、心脏介入器械)的技术突破。(详见表1)
产品结构显著分化 Ⅱ类医疗器械为获证主力
按照产品风险分类来看,今年上半年我国获得FDA认证的医疗器械产品以Ⅱ类医疗器械为主,Ⅰ类医疗器械获证数量持续低迷,产品结构显著分化。
在我国近年来获得FDA认证的医疗器械中,Ⅰ类医疗器械数量持续低迷,2024年下半年有7项获得认证,今年上半年有10项获得认证。Ⅰ类医疗器械产品多为低风险、结构简单的基础医疗器械(如医用手套、普通敷料等),技术门槛低、利润空间有限。从低迷的获证数量可以看出,我国医疗器械企业的战略重心已逐步转移。
Ⅱ类医疗器械是近年来获得FDA认证的绝对主力。今年上半年,国产医疗器械获得FDA认证的Ⅱ类产品有247项,并且自2023年下半年起连续4个半年度获证数量均保持在230项以上。Ⅱ类医疗器械产品(如医用监护仪、中高端康复设备等)风险适中、临床应用广泛,兼具技术附加值与市场需求,成为企业出海的核心选择。值得注意的是,从申请到获证的平均时间来看,Ⅱ类医疗器械的平均获证时间较Ⅰ类医疗器械短近2个月。这体现出我国医疗器械企业对FDA的Ⅱ类医疗器械申报流程的熟悉程度不断加深。
对于企业而言,选择申报Ⅱ类医疗器械,不仅能凭借产品适中的风险等级和较高的技术附加值获得更广阔的市场空间,还能因更短的获证周期加快产品上市节奏,从而获得更高的投入产出比。
头部企业集中获证 产业资源集聚效应显著
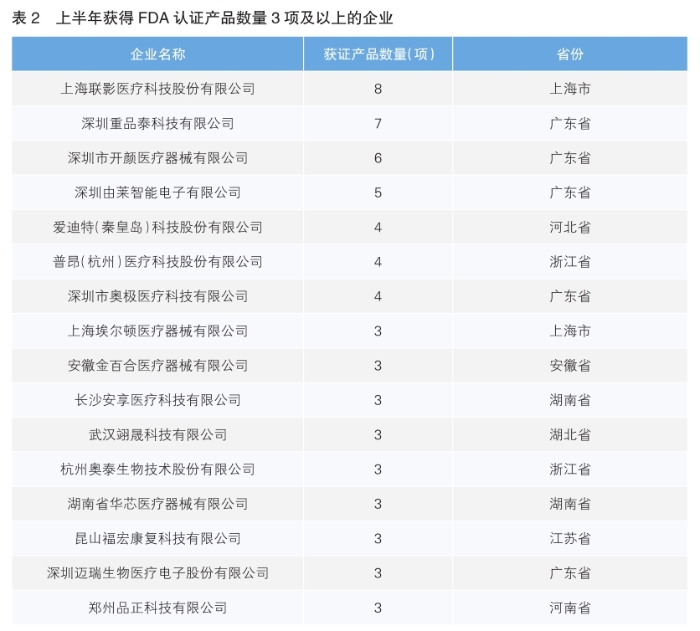
在企业表现方面,今年上半年,产品获得FDA认证的企业数量为194家,与近三年同期基本持平(2023年上半年为187家、2024年上半年为193家),但获证产品数量增长显著高于企业数量增长,呈现“少数企业集中获批多款产品”的特征。其中,上海联影医疗以8项产品获证位居榜首,其CT、核磁共振等高端影像设备持续获得国际认可;深圳童品荟科技(7项)、深圳开颜医疗器械(6项)等企业紧随其后,彰显出头部企业在研发投入、国际法规应对上的优势。(详见表2)
从地域分布来看,获证产品所属企业的地域分布高度集中,产业资源集聚效应显著,珠三角、长三角地区成为核心引擎。
广东省以90家企业的数量位居第一,其中深圳(31家)、广州(11家)贡献了主要力量。长三角地区各省(市)企业数量相当。
多重因素助力出海 国际化发展迈入新阶段
我国医疗器械产品获得FDA认证数量持续增长的背后,是政策、市场和技术多重因素形成的驱动力。
政策扶持为我国医疗器械产品出海注入动力。国家层面,《“十四五” 医疗装备产业发展规划》提出,加强品牌建设,提升国际竞争能力,鼓励骨干企业创新资本、技术、品牌等合作模式,整合国内外、多领域优质资源,布局全球发展;同时,国内医疗器械集采持续推进,“以量换价”机制压缩了产品利润空间,促使企业将目光投向海外市场以寻求新增长。地方层面,多地出台政策,通过提供海外注册补贴等,降低企业出海成本,形成“国家 + 地方”的政策协同。例如,《北京经济技术开发区关于促进医药健康产业高质量发展的若干意见》提出,对首次获得FDA、欧洲药品管理局(EMA)等机构批准,获得境外上市资质并在相关国外市场实现销售的药品、医疗器械等产品,按照实际销售额1∶1的比例给予一次性支持;《深圳市全链条支持医药和医疗器械发展若干措施》提出,支持重点药械企业拓展海外业务,鼓励企业在海外设立子公司或开展跨境投融资并购,进行海外药械注册证申报,同时对通过FDA、EMA、欧洲共同体等药品监管机构批准上市并实现销售的药品和医疗器械产品,择优给予支持。
从技术角度看,随着出海经验积累,我国医疗器械企业的国际合规能力不断提升,对FDA认证流程的把控日益成熟。许多头部企业组建专职法规团队,覆盖产品设计、临床数据整理、申报材料撰写等全流程。尤其广东省部分企业自2010年起就积极布局东南亚、欧美市场,积累了丰富的国际法规应对经验,为产品获得FDA认证打下了基础。同时,我国医疗器械产业链日渐成熟,也为产品出海提供了助力。以广东省为例,目前深圳、广州等地已形成从核心部件研发到成品生产的完整产业链,配套企业超过5000家,降低了企业出海的供应链成本。
市场需求释放也进一步推动企业开启战略转型。国内市场竞争加剧,推动企业向海外市场寻求增量。美国市场作为全球最大的医疗器械消费市场,对中高端产品的需求稳定,成为企业突破增长瓶颈的关键选择。
总的来看,我国医疗器械出海已从“数量积累”迈向“质量提升”阶段。未来,随着高风险医疗器械(如心脏瓣膜、神经介入器械等)的研发突破,以及企业对FDA最新法规的适应,国产医疗器械在国际市场的份额有望进一步提升。同时,地域产业集群的优势将持续放大,珠三角、长三角区域或将成为全球医疗器械创新与出海的核心枢纽。 (作者单位:高端医械院数据中心)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:张可欣)
分享至
右键点击另存二维码!
-
为你推荐
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有











