2月份中美欧批准上市新药盘点 三款我国自主研发的新药在全球范围内首次获批上市
- 2025-04-10 10:27
- 作者:陈倩
- 来源:中国医药报
2025年2月中美欧批准上市的新药中,欧盟批准上市的新药数量最多,为9款;中国批准8款新药上市;美国批准2款新药上市。
中国批准八款新药上市
2月份,我国批准了8款新药上市,根据Pharmadigger数据库,磷酸萘坦司韦、菲诺利单抗和斯泰度塔单抗为全球范围内首次批准上市新药,且均为我国企业自主研发的新药。
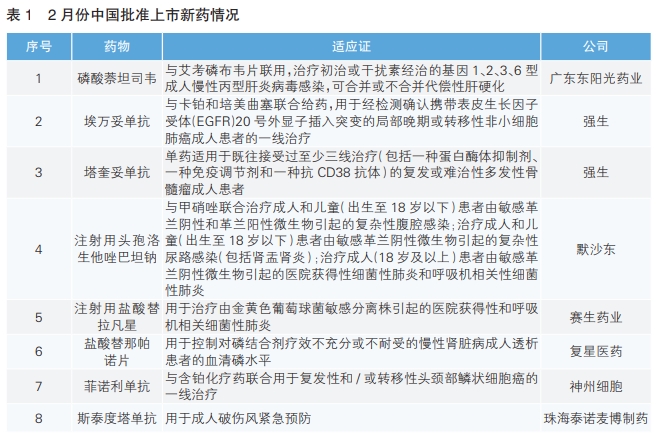
磷酸萘坦司韦(商品名:东卫卓)为广东东阳光药业自主研发的非结构蛋白5A(NS5A)抑制剂。该药获批与艾考磷布韦片联用,治疗初治或干扰素经治的基因1、2、3、6型成人慢性丙型肝炎病毒感染,可合并或不合并代偿性肝硬化。该联合疗法的Ⅱ期临床试验结果显示,受试者总体SVR12(治疗结束后12周的持续病毒学应答率)为96.7%;该方案在基因1、2、3、6型受试者中SVR12分别为96.2%、100.0%、83.3%、100.0%;代偿期肝硬化和无肝硬化受试者总体SVR12分别为100%和96.2%,表明受试者肝硬化状态对疗效结果无影响。
埃万妥单抗(商品名:锐珂)是强生研发的EGFR/MET双特异性抗体疗法。该药本次获批是基于一项名为PAPILLON的Ⅲ期临床研究结果。该研究结果表明,与单独化疗相比,埃万妥单抗联合化疗可将含有EGFR 20号外显子突变的非小细胞肺癌患者疾病进展或死亡风险降低61%。
塔奎妥单抗(商品名:拓立珂)是强生研发的GPRC5D×CD3双特异性抗体,通过重定向T细胞诱导杀伤带有GPRC5D表达的多发性骨髓瘤细胞,从而抑制肿瘤的形成和生长。GPRC5D是一种新型多发性骨髓瘤靶标,在多发性骨髓瘤细胞和非恶性浆细胞以及一些健康组织如皮肤和舌上皮细胞表面高度表达。
赛生药业的注射用头孢洛生他唑巴坦钠(商品名:卓利达)是默沙东研发的一种复方抗菌药物,由头孢类抗生素头孢洛生(Ceftolozane)和β-内酰胺酶抑制剂他唑巴坦(Tazobactam)组成。该产品已于2014年在美国获批上市。
复星医药的注射用盐酸替拉凡星(商品名:Vibativ)是一种能够快速杀菌的糖肽类抗生素,对耐甲氧西林金黄色葡萄球菌在内的革兰氏阳性病原菌有杀菌活性。该产品具有独特的双重抗菌作用机制,一方面通过抑制细菌细胞壁合成,另一方面与细菌细胞膜结合,干扰膜的屏障功能,从而快速发挥杀菌作用。与万古霉素相比,该药的半衰期更长,每日仅需给药1次。
盐酸替那帕诺片(商品名:万缇乐)是一款口服肠道钠/氢交换体3(NHE3)抑制剂,其通过抑制NHE3,使细胞间连接变得紧密,降低肠道磷酸盐吸收的主要途径——细胞旁途径磷酸盐的通透性,减少磷酸盐的吸收,从而降低血磷。该药本次获批是基于一项随机、双盲、安慰剂对照研究。结果显示,与单用磷结合剂治疗相比,该药与磷结合剂联用治疗8周,患者血磷进一步下降。
菲诺利单抗(商品名:安佑平)是神州细胞自主研发的一款重组人源化抗PD-1单克隆抗体。一项Ⅲ期临床研究结果表明,与单纯化疗相比,菲诺利单抗联合化疗可显著延长患者总生存期和无进展生存期,并提高客观缓解率。该药本次获批的适应证为与贝伐珠单抗注射液联合用于既往未接受过系统治疗的不可切除或转移性肝细胞癌患者。
斯泰度塔单抗(商品名:新替妥)是珠海泰诺麦博制药自主研发的重组抗破伤风毒素单克隆抗体。其作用机制是通过结合破伤风毒素的AB片段,发挥被动免疫作用。研究显示,在斯泰度塔单抗给药后12小时内,约有95%的患者达到保护水平,起效迅速,显著高于人破伤风免疫球蛋白组。
美国批准两款新药上市
2月份,美国批准上市2款新药。根据Pharmadigger数据库,均为全球范围内首次批准上市的新药。

SpringWorks的Mirdametinib(商品名:Gomekli)是一种口服别构小分子MEK抑制剂,靶向MEK1和MEK2,是首个获批可同时用于治疗成人和儿童1型神经纤维瘤病相关丛状神经纤维瘤的药物。1型神经纤维瘤病是一种遗传性疾病,患者一生中约有30%至50%的风险发展为丛状神经纤维瘤(PN)。PN沿着外周神经鞘以浸润性方式生长,可能导致严重容貌畸形、疼痛和功能障碍,还可能转变为恶性外周神经鞘瘤,这是一种侵袭性且可能致命的疾病。该药本次获批是基于一项名为ReNeu的Ⅱ期临床试验,结果显示Mirdametinib在成人和儿童患者中均达到了客观缓解率的主要终点。
Deciphera的Vimseltinib(商品名:Romvimza)是一种口服酪氨酸激酶抑制剂。腱鞘巨细胞瘤(TGCT)是一种罕见的非恶性肿瘤,发生在关节内或关节附近,由CSF1基因失调导致CSF1过度产生引起。尽管是良性肿瘤,但这些肿瘤仍可能对周围组织和结构造成损害,导致关节疼痛、肿胀和活动受限。该药本次获批是基于一项名为MOTION的Ⅲ期临床试验,结果显示与安慰剂相比,接受Vimseltinib治疗的患者群在第25周时的总缓解率显示出具有统计学显著性和临床意义的改善。
欧盟批准九款新药上市
2月份,欧盟批准9款新药上市,根据Pharmadigger数据库,Seladelpar、Tiratricol、Garadacimab、Catumaxomab为全球范围内首次批准上市新药。

吉利德的Seladelpar(商品名:Hetronifly)是一种口服的强效选择性过氧化物酶体增殖物活化受体δ(PPARδ)激动剂。原发性胆汁性胆管炎是一种罕见的慢性自身免疫性胆管疾病,会导致肝损伤,若不治疗,可能进展为致命的肝功能衰竭。该药本次获批是基于一项名为RESPONSE的Ⅲ期临床试验。结果显示,62%接受Seladelpar治疗的参与者在第12个月达到了综合生化应答这一主要终点,而安慰剂组这一数值仅为20%。
Rare Thyroid制药的Tiratricol(商品名:Emcitate)是一种甲状腺激素T3的类似物。Allan-Herndon-Dudley(AHDS)综合征是一种极为罕见的慢性严重衰弱性疾病,由甲状腺激素转运蛋白MCT8蛋白的基因编码突变引起。该药本次获批是基于一项在AHDS综合征儿童和成人中进行的Ⅱ期临床试验。结果显示,患者接受了剂量递增的该药治疗12个月后,血清T3平均浓度下降了63%,促甲状腺激素、游离T4和总T4浓度以及反向T3浓度也均有显著下降。
Arcturus 制药的Zapomeran(商品名:Kostaive)是一种新冠病毒mRNA疫苗。与常规的mRNA疫苗相比,该产品的特别之处在于其含有编码SARS-VoC-2刺突蛋白的自扩增mRNA,即携带指令制造复制酶蛋白。Zapomeran此前已于2023年11月在日本获批上市。
Galderma的Nemolizumab(商品名:Nemluvio)是一款用以抑制IL-31信号的单克隆抗体。该药本次获批主要是基于名为ARCADIA和OLYMPIA的Ⅲ期临床试验。结果显示,Nemluvio在中度至重度特应性皮炎患者和成年结节性瘙痒患者中显著改善了瘙痒、皮损和睡眠障碍。该药此前已于2022年3月在日本获批上市。
默沙东的Belzutifan(商品名:Welireg)是一种HIF-2α抑制剂。该药本次获批是基于名为LITESPARK-004和LITESPARK-005的试验结果。试验结果显示,在VHL病相关肾细胞癌患者中,Belzutifan带来的客观缓解率为49%,所有缓解均为部分缓解。Belzutifan此前已于2021年8月在美国获批上市。
CSL公司的Garadacimab(商品名:Andembry)是一种抗FXIIa的单克隆抗体,特异性抑制血浆蛋白FXIIa,每月只需1针。FXII被激活时,会启动导致血管性水肿形成的级联反应。该药本次获批是基于VANGUARD及其开放标签扩展研究。结果显示,约60%的遗传性血管性水肿(HAE)患者在整个治疗期间无发作,发作的中位次数降低至零,每月HAE发作次数的平均值较安慰剂减少了86.5%。
BridgeBio制药的Acoramidis(商品名:Beyonttra)是一种口服的转甲状腺素蛋白小分子稳定剂。该药本次批准是基于一项名为ATTRibute-CM的试验结果。该试验成功达成了其主要终点——以全因死亡(ACM)、心血管相关住院(CVH)、N-端脑钠肽前体水平和6分钟步行距离组成的复合终点。在第30个月时,与安慰剂相比,Acoramidis组的ACM和反复发生的CVH事件减少了42%。该药此前已于2024年11月在美国获批上市。
Lindis生物制药的Catumaxomab(商品名:Korjuny)是一种三功能双特异性单克隆抗体,可同时靶向T细胞上的CD3分子、肿瘤细胞上的EpCAM以及免疫辅助细胞上的Fcγ受体,通过激活T细胞和免疫辅助细胞,增强对肿瘤细胞的杀伤能力。Catumaxomab此前已于2009年在欧盟上市,但2017年退市,本次为重新获批。此次获批的适应证为用于腹腔内治疗上皮细胞黏附分子阳性且不适合进一步全身抗肿瘤治疗的成人患者的恶性腹水。恶性腹水是多种肿瘤终末期疾病的表现,常见于胃癌、卵巢癌、乳腺癌、胰腺癌和结肠癌等。该药此次批准是基于一项Ⅱ/Ⅲ期关键临床研究,以及其他一致性研究结果的支持。研究结果显示,Catumaxomab在主要终点无穿刺生存期上表现出显著优势,是对照组(单独穿刺)的4倍。
复宏汉霖的斯鲁利单抗(商品名:Hetronifly)是一款重组人源化抗PD-1单抗注射液。该药本次获批主要是基于ASTRUM-005研究。斯鲁利单抗联合化疗对比安慰剂联合化疗用于广泛期小细胞肺癌一线治疗,结果显示斯鲁利单抗组的中位总生存期达到15.4个月,相比安慰剂组的10.9个月有明显延长。斯鲁利单抗此前已于2022年在中国获批上市。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:张可欣)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐